 |
Основные реакции и процессы сталеплавильного производства
|
|
|
|
1. Термодинамика сталеплавильных процессов
Металлургия стали в настоящее время не является уже чисто прикладной наукой, "сборником технологических рецептов", каким она была несколько десятков лет назад. Сейчас невозможно не только развитие и совершенствование сталеплавильных процессов, но и получение качественной стали без использования данных современной науки, и прежде всего физической химии, физики, теплотехники, металлографии.
В ходе сталеплавильных процессов выделяется (или поглощается) теплота, достигается (или нарушается) равновесие протекающих реакций, лучистая энергия факела или электрической дуги превращается в тепловую и происходят другие энергетические процессы. Науку, изучающую законы теплового равновесия и превращения теплоты в другие виды
анергии, называют термодинамикой. Химическая термодинамика изучает равновесие химических реакций, их тепловые эффекты. Обычно сталеплавильный агрегат представляет собой довольно сложную систему. Для характеристики системы используют величины, называемые параметрами состояния и параметрами процесса.
Параметры состояния- величины, служащие для характеристики состояния системы (давление, объем, температура, концентрация).
Параметры процесса — величины, характеризующие процесс, т.е. изменение системы, связанное с изменением параметров состояния. К их числу относятся энтальпия1, энтропия2, энергия Гельмгольца, энергия Гиббса.
В 1882 г. известный немецкий ученый Гельмгольц ввел понятия "свободной энергии" (энергия Гельмгольца) и "связанной энергии". Энергия Гельмгольца А определяется через внутреннюю энергию U (энергия движения молекул, внутримолекулярного движения атомов, их взаимодействия, энергия движения электронов и т.п.), энтропию S и температуру Т равенством
|
|
|
А = U - TS.
Энергию Гельмгольца называют "свободной энергией при постоянном объеме"; также используют название "изохорно-изотермический потенциал" (сокращенно "изохорный потенциал").
Сталеплавильные процессы обычно протекают при давлениях, близких к постоянным (т.е. являются изобарическими); для оценки этих процессов используют параметр G, предложенный американским ученым Гиббсом, определяемый через энтальпию Н:
G = H-TS.
Энергия Гиббса связана с энергией Гельмгольца соотношением
G = A + pV,
где р— давление, V— объем.
----------------------
'Энтальпия (от греч. enthalpo — согреваю). 2Энтропия (от греч. entropia — поворот, превращение).
 В технической литературе можно встретить разные названия энергии Гиббса: свободная энергия (при постоянном давлении), термодинамический потенциал, изобарно-изотер-мический потенциал, изобарный потенциал и другие и разные обозначений этой величины: F, Z, Ф, G. 18-тый конгресс Международного союза чистой и прикладной химии в 1961 г. рекомендовал использовать символ G и название "энергия Гиббса". В настоящее время не существует методов определения абсолютного значения величин U, A, H, S, G. Для проведения термодинамических расчетов условились принимать энтальпию простых веществ (элементов) при 25 °С (298 К) равной нулю (Я298 = 0); энтропии всех веществ принимают равными нулю при абсолютном нуле (S0 = 0 при Т = 0). Соответственно для термодинамических расчетов используют величины изменения Я, S, G, а именно: ДЯ, AS, AG. Напомним, что При постоянном давлении Qp = —ДЯ.
В технической литературе можно встретить разные названия энергии Гиббса: свободная энергия (при постоянном давлении), термодинамический потенциал, изобарно-изотер-мический потенциал, изобарный потенциал и другие и разные обозначений этой величины: F, Z, Ф, G. 18-тый конгресс Международного союза чистой и прикладной химии в 1961 г. рекомендовал использовать символ G и название "энергия Гиббса". В настоящее время не существует методов определения абсолютного значения величин U, A, H, S, G. Для проведения термодинамических расчетов условились принимать энтальпию простых веществ (элементов) при 25 °С (298 К) равной нулю (Я298 = 0); энтропии всех веществ принимают равными нулю при абсолютном нуле (S0 = 0 при Т = 0). Соответственно для термодинамических расчетов используют величины изменения Я, S, G, а именно: ДЯ, AS, AG. Напомним, что При постоянном давлении Qp = —ДЯ.
Общее уравнение для определения изменения энергии Гиббса AG при температуре Т
AGT = ДЯТ - TASr.
Для проведения практических расчетов и сравнимости получаемых результатов оказалось удобным определять изменения для каждого рассматриваемого процесса (реакции) при стандартных условиях. В качестве стандартных обычно принимают условия, при которых парциальные давления для каждого компонента равны 100 кПа, активности каждого компонента равны 1, а конденсированные вещества (жидкости и твердые тела) в чистом виде находятся под давлением 100 кПа. Для того чтобы показать, что параметры заданы при стандартных условиях, используют индекс ° (ДС7°, ДЈ°, ДЯ°). Между стандартным изменением AG° и константой равновесия существует непосредственная связь:
|
|
|
AG° = -RT In Kp.
Это соотношение применимо для любой температуры. В качестве "стандартной" принимают обычно температуру 25 °С, т.е. 298,15 К (обозначают индексом 298). При стандартных условиях и стандартной температуре параметры процесса обозначают следующим образом: AG%m, ДЯ°98, AS%9i.
100 кПа = 1 атм.
В большинстве случаев температура металлургических процессов существенно отличается от стандартной, поэтому величины ДЯ могут существенно отличаться от величины АЯ°98. Изменение величины ДЯ в зависимости от температуры связано с изменением теплоемкости:
Г
dH/dT = ДСР; ДЯТ = ДЯ°ЭД + $ ACpdT.
2 98
Если в пределах исследуемых температур происходит изменение состояния какого-либо компонента (аллотропическое превращение, плавление, испарение — это также обычно указывается в таблицах), то тепловой эффект этого изменения (часто используют понятие теплоты превращения Lnp или Ј?пр) должен быть учтен в расчетах:
^ПР у
ДЯТ = ДЯ°98 + 5 ACvdT±Lm+ $ ACpdT.
298 '"пр
Значения величины изменения энтропии AS° при изменении температуры также изменяются. Уравнение для расчета значений изменения энтропии при изменении температуры имеет
вид
Т ДСР Л5° = S —zr dT.
о На практике зачастую температурные условия по ходу процесса существенно меняются. Это необходимо учитывать, чтобы дать тому или иному процессу точную количественную
оценку.
Чаще всего используют формулу
AG = AH- TAS, где ДЯ и AS близки к средним значениям ДЯ и AS для данного интервала температур. В таблицах значения приводят обычно в виде AG = А + ВТ.
При изменении температуры изменяются и ДЯ и AS, но AS изменяется в большей мере, в результате оказывается, что AG < 0; при равновесии AG = 0, поэтому величина AG, если реакция написана в направлении ее протекания, всегда получается с минусом. Если в результате расчета величина AG
|
|
|
 получается с плюсом, то реакция (процесс) идет в обратном направлении. Процесс или реакция могут идти самопроизвольно лишь в том случае, когда энергия Гиббса системы уменьшается.
получается с плюсом, то реакция (процесс) идет в обратном направлении. Процесс или реакция могут идти самопроизвольно лишь в том случае, когда энергия Гиббса системы уменьшается.
Изменение энергии Гиббса используют для определения меры химического сродства веществ. Константа равновесия Кр характеризует степень протекания реакции в ту или иную сторону. Поскольку ДО° = Д#°-ТД50 и AG° * -RTln Кр, то -RTla Кр = ДЯ° - ГД5Я, откуда R In Кр = Д5°-ДЯ°/Г. Отсюда видно, что чем больше величина AS° и чем Меньше ЬН°/Т, тем полнее идет реакция. Из уравнения видно также, что чем выше температура, тем большее значение имеет величина Д5° (энтропийный фактор) и меньшее LH°/T (энтальпийный фактор). При производстве стали протекают процессы окисления железа и его примесей (углерода, кремния, марганца) и образования соответствующих оксидов (СО, SiOj, MnO). Способность железа и его примесей окисляться, т.е. химическое сродство к кислороду, часто выражают при помощи давления диссоциации оксидов. Давление диссоциации* в
данном случае представляет собой давление кислорода р
Ог
при равновесии системы кислород—оксид: Ме + 02 = Ме02;Кр = аШе0у(аш.Ро).
В случае чистых металла и оксида а = 1 и а =
(МеОг) Me
= 1, а тогда
Кр = 1/р и bG° = RT In p.
Таким образом давление диссоциации является мерой прочности оксида: чем меньше эта величина, тем прочней оксид.
В сталеплавильной ванне участвующие в реакциях компоненты находятся в виде раствора в металле (железе) и шлаке.Вещество, переходя в раствор, становясь компонентом раствора, теряет свою индивидуальность. Значения термодинамических функций для процессов, реакций, происходящих между веществами, находящимися в растворе, существенно отличаются.
«Прежнее название — упругость диссоциации.
Обычно в качестве стандартного состояния выбирают либо чистое вещество, либо однопроцентный раствор этого вещества.
Если р — давление пара компонента, находящегося в растворе, а р° — давление пара компонента в стандартном состоянии, то отношение р/р° принято называть активностью данного компонента и обозначать а, т.е. р/р° = а. Активность вещества в стандартном состоянии принимают равной единице.
|
|
|
Для термодинамических расчетов активность представляет собой вспомогательную расчетную величину, которая «характеризует степень связанности молекул, атомов или ионов исследуемого компонента. При образовании данным компонентом в растворе каких-либо соединений его активность понижается, и, Наоборот, активность возрастает при уменьшении сил взаимодействия между частицами растворителя и растворенного вещества.
Большинство компонентов, встречающихся в металлургической практике, образует в железе растворы, далекие от идеальных. Соотношения между составом и свойствами большинства реальных растворов очень сложны и не всегда ясны. Положение облегчается тем, что обычно мы имеем дело с растворами в железе небольших количеств (часто < 1 %) других компонентов. При уменьшении концентрации растворенного вещества свойства реального раствора приближаются к свойствам идеального. Такие растворы принято называть бесконечно разбавленными или разбавленными. В этих случаях принято использовать закон Генри, согласно которому в разбавленном растворе давление пара растворенного вещества Pi прямо пропорционально его концентрации ch т.е. pj-rcj, где г — коэффициент (константа Генри). Обычно реальные растворы подчиняются закону Генри при изменении концентрации в интервале от долей процента до нескольких процентов.
В достаточно сильно разбавленном растворе можно принять активность- равной концентрации: aj = Cj или aj = Xj. При повышении концентрации растворенного компонента приходится вводить вспомогательную величину yj = aj/xj, соответственно at■, = "gjXj. Величина у h называемая коэффициентом активности, характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от
 его свойств в идеальном растворе. Для идеальных растворов 7 = 1. К таким растворам близки растворы никеля, кобальта, марганца, хрома в железе.
его свойств в идеальном растворе. Для идеальных растворов 7 = 1. К таким растворам близки растворы никеля, кобальта, марганца, хрома в железе.
Для обозначения коэффициентов активности обычно используют буквы г или /. Буквой у обозначают коэффициент активности при использовании соотношения aj = jjXj, т.е. тогда, когда концентрация выражается в мольных долях (компонента /). Если массовая концентрация выражается в процентах, то для обозначения чаще используют букву /. В реальных условиях на величину коэффициента активности компонента в растворе влияет взаимодействие растворенных в металле других компонентов. В тех случаях, когда компонент растворен в металле, принято! использовать квадратные скобки, например [С], [Mn], [Si] и т.д. В случаях, когда речь идет о концентрации того или иного компонента в шлаке, используют круглые скобки: (FeO), (MnO), (СаО) и т.д.
|
|
|
Таким образом, если написано [Mn] + (FeO) = (MnO) + + Fex, то это означает, что реакция происходит между растворенным в металле (железе) марганцем и растворенной в шлаке закисью железа. Константа равновесия этой реакции может быть записана следующим образом:
^М„= *(МпО) или ^М„= У(МП0)(МП0)
Vn]a(FeO) yMn[Mnl3f(FC0)Fe°
„М„ '(MnO)(Mn0)
или К =--------------
WMn]''(FeO)(Fe0)'
2. Кинетика сталеплавильных процессов
Если термодинамика позволяет получать ответы на вопросы о том, каково направление протекания процесса, какое количество энергии при этом выделяется (поглощается), какова характеристика последней стадии процесса, каково соотношение концентраций (активностей), при которых наступает состояние равновесия, то кинетика позволяет ответить на вопрос о том, какова скорость процесса, ее зависимость от отдельных параметров.
В общем случае протекание реакции в сталеплавильной ванне может быть представлено в следующей последовательности:
а) подвод реагентов к месту реакции;
б) акт химической реакции;
в) выделение продуктов реакции в отдельную фазу и их
удаление.
В каждом конкретном случае одно из этих звеньев может лимитировать протекание процесса в целом, если скорость данного звена процесса будет меньше, чем двух других. Для большинства металлургических реакций при температурах сталеварения сам акт химической реакции протекает практически мгновенно и не лимитирует протекание процесса вце-лом. Скорость процесса в целом в значительном числе случаев определяется скоростью подвода реагентов к месту реакции (например, интенсивностью подачи кислорода при продувке металла в конвертерном процессе или интенсивностью диффузии примесей металла к границе металл—шлак и т.п.).
В некоторых случаях, когда в результате реакции должна образоваться новая фаза (например, образование пузырька газа внутри стальной ванны, образование неметаллического включения, образование твердого кристаллика металла при кристаллизации стали), скорость процесса в целом может быть лимитирована скоростью процесса зарождения и выделения новой фазы.
Это связано с тем, что в обычных условиях зародыши любой новой фазы становятся устойчивыми лишь при достижении определенных (критических) размеров. Рост зародыша до этих размеров приводит к увеличению свободной энергии системы. Этот начальный рост свободной энергии вызван затратой работы (энергии) на создание поверхности раздела между зародышем новой фазы и исходной фазой. Буквенным символом величины энергии, затрачиваемой на образование единицы поверхности (называемой поверхностным натяжением), обычно служит сг, а обозначение ее является Дж/м2 (энергия на единицу поверхности) или Н/с (сила на единицу длины). Обычно термин "поверхностное натяжение" применяют при рассмотрении свойств тела на границе с газовой фазой, т.е. в тех случаях, когда можно пренебречь поверхностным натяжением второй фазы. Для случая поверхности раздела жидкость—жидкость (например, металл—шлак) применяют термин "межфазное натяжение". Процессы, связанные с уменьшением энергии системы, протекают самопроизвольно. Соответственно и процессы, связанные с уменьшением величины по-

 верхностного натяжения, также будут протекать самопроизвольно. При этом в поверхностном слое будет повышаться концентрация того из компонентов, прибавление которого понижает поверхностное натяжение (явление адсорбции). Вещества, снижающие поверхностное натяжение растворителя, т.е. вещества, концентрация которых в поверхностном слое выше, чем в растворителе, называют поверхностно-активными веществами. Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и ряд других в растворе жидкого железа, являются поверхностно-активными (рис. 73). Величина поверхностного натяжения чистого железа с составляет примерно 1,8 мДж/м2. Небольшие добавки поверхностно-активных элементов снижают величину а
верхностного натяжения, также будут протекать самопроизвольно. При этом в поверхностном слое будет повышаться концентрация того из компонентов, прибавление которого понижает поверхностное натяжение (явление адсорбции). Вещества, снижающие поверхностное натяжение растворителя, т.е. вещества, концентрация которых в поверхностном слое выше, чем в растворителе, называют поверхностно-активными веществами. Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и ряд других в растворе жидкого железа, являются поверхностно-активными (рис. 73). Величина поверхностного натяжения чистого железа с составляет примерно 1,8 мДж/м2. Небольшие добавки поверхностно-активных элементов снижают величину а
на 20—30 %, при этом соответственно увеличивается адсорбция этих элементов в поверхностном слое (например, на границе металл—шлак, металл—под, жидкий металл—растущий кристалл при застывании металла). Особенность поверхностных явлений заключается в том, что при их наличии проявляется действие ничтожных концентраций примесей (такие же концентрации примесей, но равномерно распределенные в объеме вещества, не могут оказать существенного влияния на объемные свойства).
Роль поверхностных явлений в металлургических процессах чрезвычайно велика. Большинство металлургических процессов основано на гетерогенных реакциях, связанных с исчезновением одних и появлением других фаз; сами реакции во многих случаях протекают на границе раздела фаз. Поэтому приходится учитывать, что и свойства, и составы пограничных слоев отличаются от объемных свойств.
 N
N
X/бОО •шо\-
| 800 |
| 0,2 Ofi |
ъ
| 0,6 |
| О.П |
0,8 0,02 0,06 0,10 СО],'/.
Рис. 73. Влияние серы и кислорода на поверхностное натяжение жидкого железа 214
При образовании новой фазы сначала в результате флуктуации должны образоваться термодинамически устойчивые зародыши новой фазы. Вероятность флуктуации определяется работой, необходимой для ее осуществления, а эта работа связана с большей удельной поверхностью зародыша и поэтому зависит от величины поверхностного натяжения на границе зародыш—среда. Чем меньше поверхностное натяжение, тем меньшая работа требуется для образования зародыша, тем благоприятнее условия для образования (выделения) новой фазы. Следовательно, наличие в металле поверхностно-активных примесей облегчает условия выделения (образования) новой фазы, например образования в металле пузырьков газа, неметаллических включений, кристаллов). Эти же поверхностно-активные вещества, адсорбируясь на растущей фазе, могут затормозить ее рост. На этом свойстве поверхностно-активных примесей основаны, например, способы модифицирования чугуна и стали. Небольшая добавка такого элемента, как бор, позволяет получать мелкозернистую структуру металла.
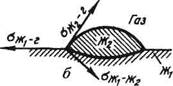
Выше уже отмечалось, что в металлургии многие процессы протекают на границе раздела фаз. В связи с этим при решении многих практических задач приходится учитывать также различную степень смачиваемости между различными фазами. Практика показывает, что разделение отдельных фаз (например, отделение шлака от металла) встречает определенные трудности, так как почти всегда на границе раздела происходит взаимное притяжение фаз. Это явление называют адгезией. Работа, которую необходимо затратить для разделения двух фаз (обычно рассматривают случай, когда площадь контакта равна 1 м2 или 1 см2), называют работой адгезии.
Если жидкая фаза (например, шлак) соприкасается с твердой (например, огнеупором), то капля шлака, расплавленная на поверхности огнеупора (рис. 74), испытывает одновременно воздействие трех величин: сш-г, ^ш-огн и
^огн-г-
Силы поверхностного натяжения стремятся уменьшить поверхности контактирующих фаз. В результате наступает равновесие трех сил:
°огн-г.= аш-огн + tfui-rcos е-
 | |||||
 | |||||
 |
|

°ш-огн \ Огнеупор
Рис. 74. Схема образования капли шлака на твердой поверхности (я) и на поверхности жидкого металла (б): 2Kj — металл; Ж2 — шлак
| в"90' |
| в'О |
| в |
в'ТвО* в>90'
>mvww)/////w///Ј/s/;w///}/s
Рис. 75. Межфазное натяжение и смачиваемость
Угол 0 называют краевым углом смачивания. Величина угла 0 определяется соотношением
cos 0 = (tfor-н-г - 0"ш-огн)/°'ш-г или в общем случае
COS 0 = (о-тв_г - Сж-тв)/(Уж-г-
В зависимости от природы контактирующих фаз угол смачивания изменяется от 180 до 0°. При 0 = 180° имеет место случай полного несмачивания. На практике почти всегда происходит частичное смачивание (рис. 75) и величина угла 0 колеблется в широких пределах. Знание степени смачивания и величины краевого угла смачивания помогает решать многие практические задачи. Если, например, известно, что при соприкосновении жидкого шлака определенного состава с футеровкой величина краевого угла смачивания невелика (0 < 90°), то этот шлак будет проникать в поры огнеупорного материала. Если же не желательно, чтобы происходило это проникновение, то необходимо подбирать такие составы шлаков (или огнеупоров), при которых величина краевого угла смачивания была бы большой (0 > 90°). Другой пример: если между металлом и находящимся в нем неметаллическим включением смачивание плохое, то это включение будет
быстрее отделяться от металла, чем в случае, когда смачивание между включением и металлом хорошее. Силы смачивания мешают полностью отделять шлак от металла. Кроме сил взаимного притяжения различных фаз на границе их раздела, необходимо учитывать силы взаимного притяжения внутренних слоев вещества. Явление взаимного притяжения внутренних слоев тела жидкости называют когезией. Если, например, взять столб металла сечением 1 м2 и разорвать (разделить) на два столба такого же сечения, то образуются две новые поверхности, каждая по 1 м2. На образование поверхности в 1м2 затрачивается энергия, численно равная величине поверхностного натяжения с (Дж/м2). Следовательно, в рассматриваемом примере будет затрачена энергия, равная 2о*. Явление когезии особенно приходится учитывать, когда по технологии необходимо раздроблять струю металла или шлака, в случаях образования трещин в застывающем слитке и в ряде других случаев.
3. Сталеплавильные шлаки
Выплавка стали обычно сопровождается процессами окисления железа и его примесей, а также процессами разъедания футеровки сталеплавильных агрегатов. В шихте, загружаемой в сталеплавильные агрегаты, всегда имееется большее или меньшее количество загрязнений. Кроме того, при ведении плавки в ванну обычно добавляют различные флюсы и добавочные материалы. В результате образуется неметаллическая фаза, называемая шлаком.
Источники образования шлака
Основные источники образования шлака следующие:
1. Продукты окисления примесей чугуна и лома — кремния, марганца, фосфора, серы, хрома и других элементов (Si02, MnO, Р205, FeS, MnS, Сг2Оэ и др.).
2. Продукты разрушения футеровки агрегата — при разъедании основной футеровки (доломита, магнезита) в шлак переходят CaO, MgO, при разъедании кислой (динас) — Si02.
3. Загрязнения, внесенные шихтой (песок, глина, мик-серный шлак и т.п.), - Si02, Al203, MnS и т.п.
4. Ржавчина, покрывающая заваливаемый в сталеплавильные агрегаты лом, — оксиды железа.

 5. Добавочные материалы и окислители (известняк, известь, боксит, плавиковый шпат, железная и марганцевая руды и т.п.) - CaO, A1203. Si02, FeO, FejQ3, MnO, CaF2 и т.п.
5. Добавочные материалы и окислители (известняк, известь, боксит, плавиковый шпат, железная и марганцевая руды и т.п.) - CaO, A1203. Si02, FeO, FejQ3, MnO, CaF2 и т.п.
В каждом конкретном случае степень влияния перечисленных загрязнений на состав шлаков различна. Вводя после соответствующего расчета то или иное количество определенных добавок, добиваются получения шлака нужного состава. При необходимости проводят операции обновления (скачивания) шлака, когда определенное количество шлака (иногда почти 100 %) удаляют из агрегата, а затем вводя нужное количество тех или иных добавок, "наводят" новый шлак необходимого состава.
Строение и составы шлаков
После отбора пробы шлака и проведения соответствующего анализа (состав шлаков устанавливают методами аналитической химии и спектрального анализа) сталевар получает данные (в %) о том, сколько в этой пробе шлака содержится CaO, Si02, Al203, FeO, MnO и других соединений. Приходится, однако, учитывать, что в лаборатории подвергают анализу шлак, уже застывший после отбора пробы из печи. В печи же (в агрегате) шлак находится в расплавленном состоянии. Жидкие расплавленные шлаки в металлургическом агрегате характеризуются наличием между составляющими шлака и ковалентной, и ионной связи. Образование ионов при расплавлении компонентов шлака можно представить следующими реакциями:
FeO -*■ Fe2+ + О2"; CaO —* Са2+ + О2";
MnO —* Мп2+ + О2"; MgO -r* Mg2+ + О2-;
(FeO)2 • Si02 —*■ 2Fe2+ + SiOf;
(MnO)2 • Si02 —» 2Mn2+ + SiO«~;
FeS —*Fe2+ + S2"; MnS ->Mn2+ + S2';
CaF2 —* Ca2+ + 2F~;
(CaO)3 • P2Os -*ЗСа2+ + 2РОГ и т.д.
Таким образом, сталеплавильные шлаки обычно имеют в своем составе такие катионы, как Fe2+, Mr.2+, Ca2+, Mg2+,
Сг2+, и такие анионы, как S2", О2-, SiO,-, AIO5-, POf, Fe02, FeO^", Si20$", CrOj и Т.п. Кроме того, в шлаке могут быть и сложные комплексы, близкие к составам таких соединений, как (СаО)4 • Si02; (FeO)2 • Si02; (CaO)4 • • P2Os. Поэтому данные, которые сталевар получает после анализа пробы шлака, далеко не полностью отражают истинную картину того, что находится непосредственно в печи.
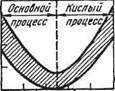
Шлаки, в которых преобладают основные окислы (СаО, MgO, MnO, FeO), называют основными шлаками, а шлаки, в которых преобладают кислотные окислы (Si02, P205) — кислыми шлаками (рис. 76). В зависимости от характера шлаков и процессы называют основными или кислыми. Обычно и характер огнеупорных материалов, из которых сделана сталеплавильная ванна, соответствует характеру процесса (характеру шлака). Например, ванну печей, в которых осуществляют кислый мартеновский процесс, изготовляют из кислых огнеупорных материалов. Иначе шлак будет энергично взаимодействовать с огнеупорной футеровкой и разрушать ее (кислотные окислы активно взаимодействуют с основными). В тех случаях, когда в агрегате вообще нет футеровки (например, при электрошлаковом переплаве), состав шлака может быть любым.
Поскольку из всех перечисленных компонентов наибольшую долю в основных шлаках занимают СаО и Si02, отношение этих окислов CaO/Si02 характеризует степень основности (или просто "основность") основных шлаков. Шлаки, в которых отношение (CaO/Si02) < 1,5, называют низкоосновными; у шлаков средней основности CaO/Si02 = 1,6+2,5; у высокоосновных шлаков (CaO/Si02) > 2,5. При переделе фосфористых чугунов шлаки содержат много Р205. В этом случае для характеристики основности шлака используют величину отношения CaO/(Si02 + Р205).
|
1600
1500
\1Ш
1Ш
1200
10 J0 30 ML 50 60 ($10,),% Рис. 76. Температуры плавления шлаков
Кислые шлаки состоят главным образом из кислотного окисла Si02 и некоторого количества таких основных окислов, как FeO и МпО. Составы кислых шлаков характеризуются степенью их кислотности (или просто "кислотностью"), выражаемой обычно отношением Si02/(FeO + МпО).
Кроме основности шлака, другой важной его характеристикой является величина, называемая "окисленностью" шлака. Эта величина характеризует способность шлака окислять металл и его примеси. В качестве меры окисленности обычно принимают или содержание (в %) в шлаке FeO, или содержащуюся в нем сумму FeO + Fe203) или содержание в шлаке железа. Существуют й другие способы определения окисленности шлака.
Помимо химического состава, важнейшей характеристикой шлака является его вязкость, которая обычно значительно выше вязкости стали. При температуре около 1600 °С вязкость стали составляет 0,0025 Па • с; вязкость относительно жидких шлаков равна 0,02—0,04 Па • с, густых - выше 0,2 Па • с (рис. 77).
Увеличение степени перегрева над температурой плавления повышает жидкотекучесть шлаков. С помощью диаграмм состояния можно определить пути снижения температуры плавления реальных шлаков. Обычно для разжижения основных шлаков используют добавки боксита (основные составляющие А12Оэ, Si02, Fe203), плавикового шпата (CaF2), боя шамотного кирпича (Si02, Al203), в некоторых случаях песка (Si02); для "сгущения" основных шлаков используют добавки извести (СаО), иногда — магнезита (MgO). Наоборот, добавки песка (Si02) "сгущают" кислые шлаки, а добавки извести их разжижают.
*По мерс ужесточения требований, связанных с охраной природы, использование фторсодержащих реагентов сокращается.

|
Рис. 77. Зависимость вязкости
шлаков (Т)) от температуры:
| то |
/ — основные ("короткие") шлаки;
| 1500 |
г, С 2 - кислые ("длинные") шлаки
Роль шлака в сталеплавильном производстве чрезвычайно велика. Удаление, например, из металла таких вредных примесей, как сера и фосфор, заключается в переводе этих элементов в шлак и создании условий, препятствующих их обратному переходу из шлака в металл. Изменяя состав шлака, его количество и температуру, можно добиться увеличения или уменьшения содержания в металле марганца, кремния, хрома и других элементов. Поэтому во многих случаях задача сталеплавильщика заключается в получении шлака необходимой консистенции и химического состава.
4. Основные реакции сталеплавильных процессов
Поскольку сталь получают обычно из чугуна и лома в результате окисления и удаления содержащихся в них примесей (кремния, марганца, фосфора и др.), особое значение в сталеплавильной практике имеют реакции окисления. Кислород для протекания этих рекций поступает или из атмосферы, или из железной руды, или из других окислителей, или при продувке ванны газообразным кислородом.
При контакте с металлом и шлаком окислительной атмосферы, содержащей кислород в виде Оа, С02 или Н20, образуются высшие оксиды железа, обогащающие шлак кислородом (например, СОг + 2(FeO) = (Fe203) + СО). Дальнейший процесс переноса кислорода из шлака в металл протекает по реакциям (Fe203) + Реж=3(РеО), а затем (FeO) —*[0] + Fe*.
Ниже рассмотрены основные реакции, происходящие при протекании сталеплавильных процессов. При этом для простоты расплавленная сталь будет рассматриваться как однородный раствор тех или иных компонентов в железе независимо от того, какая структура была у металла данного состава в твердом состоянии. Следует иметь в виду, что такое допущение не совсем верно. Температура плавления стали в зависимости от состава колеблется обычно в пределах 1400—1530 °С, а перед выпуском фактически составляет обычно 1550—1650 °С. Таким образом, рассматриваются расплавы, относительно слабо перегретые по сравнению с линией ликвидуса. У таких расплавов влияние типа структуры, свойственной твердому состоянию, сохраняется и при температурах, превышающих линию ликвидуса. При этом сохраняется так называемый "ближний" порядок расположения атомов в
температурах; при этом могут образоваться следующие оксиды: Мп02, Мп2Оэ. Мп304, МпО. При высоких температурах устойчивым является оксид МпО. Основная часть находящегося в шихте марганца поступает с чугуном. Определенное количество марганца может содержаться и в стальном ломе, загружаемом вместе с чугуном в сталеплавильные агрегаты.
Марганец, растворенный в металле, окисляется кислородом:
а) содержащимся в газовой фазе
[Мп] + 1/202газ = (МпО); AG° = -361380 - 106,07;
при протекании этой реакции выделяется много тепла;
б) содержащимся в оксидах железа шлака
[Мп] + (FeO) = (МпО) + Fex; AG° = -124000 + 56,47;
эта реакция также экзотермическая;
в) растворенным в металле
[Мп] + [О] = (МпО); AG° = -245000 + 1097;
эта реакция также протекает с выделением тепла.
Из приведенных формул видно, что перед вторым (энтропийным) членом уравнения стоит знак "плюс". Возрастание величины AG° по мере повышения температуры свидетельствует о возможности протекания при высоких температурах обратного процесса — восстановления марганца, в частности, железом: (МпО) = Реж = [Мп] + (FeO).
Марганец могут восстановить также углерод, кремний и другие элементы:
(МпО) + [С] = [Мп] + СОгаз;
2(МпО) + [Si] = 2[Мп] + Si02.
Температура, при которой прекратится окисление марганца и начнется его восстановление, зависит от состава металла и шлака (значения величины AG° для различных составов металла и шлака различны). Для условий, свойственных кислым процессам (кислые шлаки), приходится учитывать, что образующийся при окислении марганца оксид МпО (основной окисел) вступает во взаимодействие с кислотными окислами шлака:
2(MnO) + (Si02) = (MnO)2 * Si02.
Активность закиси марганца в кислом шлаке ниже, чем в основном, поэтому при прочих равных условиях в кислом процессе марганец окисляется легче и более полно, а восстанавливается менее полно, чем в основных. На процессы окисления и восстановления марганца большое влияние оказывает также окисленность шлака. Чем выше окисленность шлака, тем полнее окисляется марганец и тем более высокая температура требуется для его восстановления.
Окисление и восстановление кремния
Кремний растворяется в железе в любых соотношениях. Растворение кремния в железе происходит с выделением тепла:
Si -^[Si]; AG° =-121400 - 1,27.
Основная масса кремния, содежащегося в шихте, поступает в нее с чугуном.
Кремний — элемент легко окисляющийся. Растворенный в металле кремний может окисляться кислородом:
а) содержащимся в газовой фазе
[Si] + Оггю = (Si02); AG° = -775670 + 1987;
б) содержащимся в окислах железа шлака
[Si] + 2(FeO) = (Si02) + 2Реж; AG0 = -300000 + 987;
в) растворенным в металле
[Si] + 2[0] = Si02; AG0 = -541840 + 2037.
Все эти реакции сопровождаются выделением очень большого количества тепла.
Для некоторых процессов (например, бессемеровского) кремний является основным "топливом", т.е. тем элементом, в результате окисления которого происходит нагрев металла. Знак "плюс" перед энтропийными членами в уравнениях свободной энергии свидетельствует о том, что при повышении температуры могут создаваться благоприятные условия для восстановления кремния. Восстановление его при повышении температуры действительно происходит в кислых процессах, под кислыми шлаками, когда активность Si02 в шлаке (и в футеровке) высока, а окисленность шлака мала. Повышение окисленности шлака благоприятствует процессам окисления кремния и препятствует его восстановлению.
15-38Ш 225

 Восстанавливать кремний из кислого шлака (а также из кислой футеровки) могут железо, углерод или марганец.
Восстанавливать кремний из кислого шлака (а также из кислой футеровки) могут железо, углерод или марганец.
Окисление и восстановление фосфора
Фосфор растворяется в железе в значительных количествах. При растворении фосфора выделяется некоторое количество тепла:
?г™ —*2[Р]; AG0 =-245300 - 38Г.
Фосфор обычно считают вредной примесью в стали, и проведению операции по его удалению уделяется большое внимание.
В основе вредного влияния фосфора лежат два его свойства:
1) значительное расширение двухфазной области между линиями ликвидуса и солидуса, вследствие чего при кристаллизации слитка или отливки возникают сильная первичная ликвация (сегрегация), а также значительное сужение у-области, что облегчает развит
|
|
|


