 |
Обработка результатов эксперимента
|
|
|
|
1. Водород находится в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляют по формуле:
P = P атм − P 1 − P 2,
где Р 1 – давление столба воды в бюретке, Па, Р 1 = 9,8 hd aq, 9,8 – переводной коэффициент из мм вод.ст. в Па; d aq – плотность воды, равная 1 г/см3; Р 2 – давление насыщенного водяного пара, которое находят по таблице 1.
Таблица 1
Зависимость давления насыщенного водяного пара от температуры
| Т, К | ||||||
| Р 2, Па | 1226,4 | 1706,2 | 2332,7 | 3172,5 | 4238,9 | 5625,3 |
2. Массу выделившегося водорода m H вычисляют по уравнению Менделеева–Клапейрона:
 ,
,
где М Н – молярная масса водорода, г/моль; V – объем водорода, м3; R – универсальная газовая постоянная, равная 8,314 Дж/моль·К.
3. Вычислить эквивалент металла по закону эквивалентов:
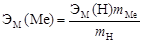 ,
,
где ЭМ(Н) – эквивалентная масса водорода, равная 1 г/экв
4. По степени окисления металла, указанной преподавателем, определить молярную массу металла. Установить, что это за металл.
5. Вычислить точное значение эквивалентной массы металла и найти относительную погрешность эксперимента:
 .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа № 2. Определение эквивалента карбоната натрия
Цель работы: провести определение эквивалентной массы карбоната натрия по известному эквиваленту диоксида углерода.
Оборудование и реактивы
В лаборатории: штатив – 1 шт., лапка – 2 шт., кристаллизатор – 1 шт., колба Вюрца объемом 50 мл с присоединенной изогнутой стеклянной трубкой – 1 шт., резиновая пробка – 1 шт., фильтровальная бумага. В вытяжном шкафу: мерный цилиндр, объемом 25 или 50 мл – 1 шт.; соляная кислота – раствор концентрацией 2 моль/кг., хлорид натрия – насыщенный раствор. Получать в лаборантской: термометр – 1 шт., барометр – 1 шт. бюретка, объемом 25 мл – 1 шт., навеска карбоната натрия с указанной массой; полоска миллиметровой бумаги длиной 30 см.
|
|
|
Выполнение работы.
1. Наполнить кристаллизатор на половину его объема насыщенным раствором поваренной соли, в котором растворимость диоксида углерода меньше, чем в воде.
2. Тем же раствором наполнить бюретку.
3. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом раствор из бюретки не вытечет.
4. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы.
5. В колбочку вместимостью 50 мл налить 8−10 мл 2 н. раствора хлороводородной кислоты вытереть горло колбы фильтровальной бумагой и закрепить ее в штативе в горизонтальном положении.
6. Навеску соли вместе с бумагой поместить осторожно в горло колбы таким образом, чтобы кристаллы не могли преждевременно упасть в кислоту, плотно закрыть колбу пробкой с газоотводной трубкой и подвести открытый изогнутый конец трубки под бюретку.
7. После этого отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки означают объем в мл, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута.
8. Вынуть колбу из штатива и медленно, чтобы не происходило очень бурного выделения диоксида углерода, пересыпать карбонат натрия небольшими порциями в кислоту аккуратными наклонами колбы. В конце опыта стряхнуть бумажку с остатками кристаллов в колбу.
|
|
|
9. По окончании выделения газа вновь закрепить колбу в штативе.
10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке,
11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе.
12. По показаниям барометра и термометра определить атмосферное давление и температуру в лаборатории.
Содержание протокола лабораторной работы
Масса навески карбоната натрия, m = ……….г.
Объем соляной кислоты, V HCl = …………….мл.
Объем насыщенного раствора хлорида натрия в бюретке в начале эксперимента V 1 = ……..мл.
Объем насыщенного раствора хлорида натрия в бюретке в конце эксперимента V 2 = ……..мл.
Объем выделившегося углекислого газа V изм = V 1 − V 2 = ……….мл.
Высота столба насыщенного раствора хлорида натрия в бюретке, h = …………..мм.
Атмосферное давление в лаборатории P атм = ……..мм.рт.ст.
Температура в лаборатории, Т = ……°С.
|
|
|


