 |
Лабораторная работа № 7. Приготовление буферного раствора
|
|
|
|
Цель работы: научиться выбирать состав буферного раствора с заданным значением рН, рассчитывать количества компонентов, необходимые для приготовления буферного раствора. Познакомиться с понятием емкости буферного раствора и научиться ее определять. Освоить современные методы измерения водородного показателя растворов с помощью рН-метров.
Общие сведения
Буферными называют растворы, способные поддерживать постоянное значение концентрации ионов водорода или гидроксила при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Способность раствора поддерживать определенную кислотность среды называют буферным действием. Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений. Основные типы буферных растворов следующие:
Смесь слабой кислоты и ее соли, например, ацетатный буфер: CH3COOH + CH3COONa. Механизм буферного действия следующий:
а) при добавлении кислоты ионы Н+ связываются анионами соли в молекулы слабой кислоты по реакции:
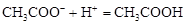 ;
;
б) при добавлении щелочи ионы гидроксила нейтрализуются слабой кислотой по реакции:
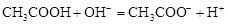 .
.
Смесь слабого основания и его соли, например, аммиачный буфер: NH4OH + NH4Cl. Буферное действие обусловлено протеканием следующих процессов:
а) при добавлении кислоты ионы Н+ нейтрализуются слабым основанием по реакции:
 ;
;
б) при добавлении щелочи ионы гидроксила связываются катионами соли в молекулы слабого основания:
 .
.
Расчет рН кислого буфера проводят на основании константы диссоциации слабой кислоты:
 ,
,
где p Kd – показатель константы диссоциации слабой кислоты, p Kd = –lg Kd; С с и С к – концентрации соли и килоты соответственно, моль/л
|
|
|
Для основного буфера можно вывести аналогичную формулу, но для расчета гидроксильного показателя:
 ,
,
где p Kd – показатель константы диссоциации слабого основания; С с и С осн – концентрации соли и основания соответственно, моль/л
Водородный показатель основного буфера вычисляют по формуле:
рН = 14 − рОН.
Интегральной емкостью буферного раствора называют число молей сильной кислоты или щелочи, которое требуется прибавить к 1 л буферного раствора для изменения его рН на единицу. После этого раствор практически утрачивает буферное действие. Дальнейшее добавление сильной кислоты или щелочи вызывает резкое изменение рН раствора. Поэтому емкость буферного раствора можно определить экспериментально путем титрования сильной кислотой или, соответственно, щелочью с цветными индикаторами. Рассчитывают емкость буферных растворов на основе формул вычисления рН. Емкость кислого буфера по щелочи, В Щ рассчитывают исходя из уравнения:
 ,
,
при решении которого получается формула:
 .
.
Емкость кислого буфера по кислоте вычисляют на основе уравнения:
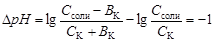 ,
,
из которого выводят расчетную формулу:
 .
.
Емкости основного буфера по кислоте и по щелочи определяются согласно уравнениям:
 и
и  .
.
Выбор состава буферного раствора. Отношение С с/ С к или С с/ С осн выбирают в пределах 0,1< С соли/ С к-ты <10. По таблицам констант диссоциации подбирают слабую кислоту с p Kd = pH±1(или слабое основание с p Kd = pOH ±1), исходя из заданного значения рНвычисляют отношение концентраций С с / С к (или С с / С осн).
Контрольные вопросы
1. Что такое буферный раствор?
2. На протекании каких реакций основано буферное действие?
3. Каковы основные типы буферных растворов?
4. Из каких основных компонентов состоит буферный раствор?
5. По какому уравнению вычисляется рН кислого буферного раствора?
6. По какому уравнению вычисляется рН основного буферного раствора?
|
|
|
7. Что такое интегральная буферная емкость?
8. Как экспериментально определить величину интегральной буферной емкости?
9. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости кислого буферного раствора по кислоте и по щелочи?
10. По какому уравнению вычисляют теоретическое значение интегральной буферной емкости основного буферного раствора по кислоте и по щелочи?
Оборудование и реактивы
В лаборатории: рН-метр; бюретка объемом 100 мл – 4 шт (или мерные цилиндры); уксусная кислота – 0,2 М раствор, ацетат натрия – 0,2 М раствор, гидроксид натрия – 0,2 М раствор, хлорид аммония – 0,2 М раствор, соляная кислота для титрования – 0,05 н. раствор, гидроксид натрия для титрования – 0,05 М раствор. В штативе с реактивами: метилоранж. Получать в лаборантской: пипетка Мора объемом 5 мл – 2 шт., мерная или коническая колба объемом 100 мл – 2 шт., коническая колба для титрования объемом 50 мл – 2 шт., стакан химический объемом 100 мл – 4 шт., стакан химический объемом 50 мл – 2 шт., бюретка объемом 25 мл – 2 шт.; фенолфталеин.
Выполнение работы
|
|
|


