 |
Опыт 9. Смещение равновесия диссоциации слабых электролитов.
|
|
|
|
А. Влияние соли слабой кислоты на диссоциацию этой кислоты. В две пробирки внести по 5–7 капель 0,1 н. раствора уксусной кислоты. В каждую пробирку прибавить одну каплю метилового оранжевого. Одну пробирку с уксусной кислотой оставить в качестве контрольной, а в другую внести 3–4 микрошпателя ацетата натрия и перемешать раствор стеклянной палочкой. Сравнить окраску полученного раствора с окраской раствора в контрольной пробирке.
Б. Влияние соли слабого основания на диссоциацию этого основания. В две пробирки внести по 5−7 капель 0,1 н. раствора аммиака. В каждую пробирку прибавить одну каплю раствора фенолфталеина. Одну пробирку с раствором аммиака оставить в качестве контрольной, а в другую добавить 3−4 микрошпателя хлорида аммония и перемешать раствор стеклянной палочкой. Сравнить окраску полученного раствора с окраской раствора в контрольной пробирке.
Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций: образование осадка, выделение газа, изменение цвета раствора и т.д.
Пример:
Опыт 1.
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl, образование аморфного осадка бурого цвета.
Опыт 2.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O, растворение осадка, образование раствора желтого цвета.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
По опыту 8 дополнительно заполнить таблицы и ответить на вопросы
| № | Название гидроксида | Химическая формула | Характер гидроксида | Уравнение диссоциации |
|
|
|
Сколько электронов находится на внешнем электронном уровне ионов Mg2+, Al3+ и атома кремния в степени; окисления +4?
В прямой или обратной зависимости находится усиление кислотных свойств гидроксидов от увеличения заряда ионов (степени окисления атомов), гидроксиды которых рассматриваются?
Радиусы ионов Mg2+, Al3+ и атома Si+4 соответственно равны (по Полингу) 0,065; 0,050 и 0,041 нм. Как влияет изменение радиусов ионов на характер химических свойств гидроксидов?
| Ион, гидроксид которого рассматривается | Радиус иона, нм | Внешняя электронная оболочка иона | Характер гидроксида | Уравнение диссоциации |
| Mg2+ | 0,065 | |||
| Ni2+ | 0,069 | |||
| Zn2+ | 0,071 |
Какое влияние оказывает внешняя оболочка ионов на характер диссоциации гидроксидов, если известно, что Mg(OH)2 − более сильное основание, чем Ni(OH)2? Сделать общий вывод о влиянии радиуса, заряда и внешней электронной оболочки ионов на характер диссоциации гидроксидов.
При написании схем диссоциации амфотерных гидроксидов учесть, что в щелочных водных растворах они переходят в комплексные гидроксоионы.
По опыту 9
Написать уравнение диссоциации уксусной кислоты и выражение константы ее диссоциации.
Под влиянием каких ионов метиловый оранжевый принимает розовую окраску?
На изменение концентрации каких ионов указывает изменение окраски метилового оранжевого?
Объяснить, как смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия.
Как меняются при этом степень диссоциации уксусной кислоты и концентрация ионов Н+?
Под влиянием каких ионов фенолфталеин принимает красную окраску в опыте 9Б?
Написать схему равновесия в растворе аммиака.
Как смещается равновесие в этом растворе при добавлении к нему хлорида аммония?
Почему при этом окраска фенолфталеина бледнеет?
4. Выводы по каждому опыту.
|
|
|
Лабораторная работа № 6. Исследование гидролиза солей
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие сведения
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты и сульфаты щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей:
Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты: А- + Н2О = НА + ОН-, в растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7. Например, Na2CO3 образован сильным основанием NaOH и слабой угольной кислотой H2CO3. Диссоциация карбоната натрия описывается уравнением:
 .
.
С водой взаимодействует карбонат-ион по реакции:
 .
.
Распределяя катионы натрия по образующимся в ходе гидролиза анионам, получим молекулярное уравнение гидролиза:
Na2CO3 + H2O = NaHCO3 + NaOH.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания: М+ + Н2О Û МОН + Н+, в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Например, FeSO4 образован слабым основанием Fe(OH)2 и сильной кислотой H2SO4. Сульфат железа (II) диссоциирует по реакции:
 .
.
С водой реагирует остаток слабого основания – катион Fe2+:
Fe2+ + HOH ® FeOH+ + H+.
Так как в ходе гидролиза образуются ионы H+, то среда в растворе FeSO4 будет кислой.
Молекулярное уравнение гидролиза:
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4.
Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов. Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть ограничивается взаимодействием иона только с одной молекулой воды.
Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону: М+ + А- + Н2О = МОН + НА. Например, ацетат натрия CH3COONa образован слабым основанием NH4OH и слабой кислотой CH3COOH, соответственно с водой взаимодействует и катион аммония и ацетат-ион:
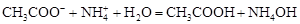
Молекулярная форма реакции:
|
|
|
CH3COONH4 + H2O = CH3COOH + NH4OH
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Пример необратимого, полного гидролиза:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
Чем слабее кислота или основание, образующиеся в результате гидролиза, тем выше глубина протекания процесса.
С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Контрольные вопросы
1. Что такое гидролиз?
2. Что является продуктами гидролиза?
3. Какие соли не гидролизуются?
4. Каковы основные типы гидролиза?
5. Как протекает гидролиз соли, образованной сильной кислотой и слабым основанием?
6. Как протекает гидролиз соли, образованной слабой кислотой и сильным основанием?
7. Как протекает гидролиз соли, образованной двумя слабыми электролитами?
8. Что такое степень гидролиза?
9. От каких факторов зависит степень гидролиза?
10. Как можно подавить гидролиз?
11. Что называется взаимным усилением гидролиза?
Оборудование и реактивы
В лаборатории: спиртовка – 1 шт., песчаная баня – 1 шт. В штативе: хлорид железа (III), сульфат цинка, сульфат алюминия, сульфат хрома (III), сульфат магния, карбонат натрия, ацетат натрия – растворы концентрацией 5 %; лакмус – раствор концентрацией 1 %. В вытяжном шкафу: соляная кислота – раствор концентрацией 15 %, сульфид натрия – раствор концентрацией 5 %. Получать в лаборантской: пробирки – 5 шт.; хлорид сурьмы (III), сульфит натрия – растворы концентрацией 5 %; хлорид олова (II) – кристаллический; цинк металлический; универсальная индикаторная бумага, фенолфталеин.
|
|
|
Выполнение работы
Опыт 1. Гидролиз солей. В отдельные пробирки налить по 3-4 капли растворов хлорида железа (III), сульфата цинка, сульфата алюминия, карбоната натрия и сульфида натрия. Добавить по 1-2 капли лакмуса и записать в таблицу окраску каждого из растворов этих солей. Вылить содержимое пробирок, промыть их дистиллированной водой и вновь налить указанные выше растворы. Добавить по 1-2 капли фенолфталеина и записать окраску растворов. Определить рН каждого раствора при помощи универсальной индикаторной бумаги.
|
|
|


