 |
Опыт 1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде
|
|
|
|
В четыре сухие пробирки внести тиосульфат натрия и воду согласно таблице 1 перемешать.
Таблица 13.
Приготовление растворов
| Номер пробирки | Число капель | |||
| Na2S2O3 | H2O | H2SO4 | Всего | |
| 4 (контрольная) |
В первую пробирку добавить одну каплю серной кислоты и включить секундомер. Определить время от момента добавления кислоты (начала реакции) до появления явной мути за счет образующейся серы – по сравнению с пробиркой № 4. То же самое проделать с двумя другими пробирками.
Опыт 2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде
Налить в одну пробирку 10 капель 1 н. раствора тиосульфата натрия, в другую – 10 капель 2 н. раствора серной кислоты.
Обе пробирки с растворами поместить в термостат, отметить температуру по термометру и термостатировать их в течение 1–2 минут.
Быстро вылить кислоту в пробирку с раствором тиосульфата, оставив последнюю в термостате. Одновременно включить секундомер и заметить время от сливания растворов до появления в пробирке явной белой мути серы.
Повторить опыт еще дважды, повышая температуру воды в термостате примерно на 10 K.
Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
Взять два небольших по возможности одинаковых кусочка мела. Один из них положить на кусочек фильтровальной бумаги и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в пробирку. Второй кусочек мела целиком опустить в другую пробирку. В обе пробирки одновременно добавить одинаковое количество (10−20 капель) концентрированной соляной кислоты. Отметить время полного растворения мела в каждом случае.
|
|
|
Опыт 4. Влияние катализатора на скорость реакции
В две пробирки внести по 10 капель 0,5 н. раствора роданида калия и по 1 капле 0,5 н. раствора хлорида железа (III). Что наблюдается? В одну из пробирок добавить 1 каплю 1 н. раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия.
Опыт 5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония
В четыре пробирки налить равное число капель 0,0025 н. растворов хлорида железа (III) и тиоцианата аммония. Первую пробирку оставить как эталон для сравнения; во вторую пробирку прилить несколько капель концентрированного раствора FeCl3; в третью пробирку добавить несколько капель концентрированного раствора NH4CNS; в четвертую пробирку на кончике шпателя прибавить кристаллического хлорида аммония и взболтать.
Сопоставить цвета растворов во всех пробирках и сделать выводы о направлении смещения равновесия, учитывая, что в реакции:
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl
цвет раствора определяет интенсивно окрашенный тиоцианат железа Fe(CNS)3.
Содержание протокола лабораторной работы
Опыт 1 – таблица 2. Зависимость времени реакции от количества тиосульфата натрия
| Номер пробирки | С(Na2S2O3) (относительные единицы) | Время реакции t, с |
| 1 (4) | ||
| 2 (8/4) | ||
| 3 (12/4) |
Опыт 2 – таблица 3. Зависимость времени реакции от температуры
| № п/п | Температура, °С | Время, t, сек. |
Опыт 3 – таблица 4. Зависимость времени реакции от степени измельчения
| № пробирки | Состав системы | Время, t, сек. |
| Мел кусочком + HCl | ||
| Мел в порошке + HCl |
Опыт 4 – таблица 5. Зависимость времени реакции от состава системы.
|
|
|
| № пробирки | Состав системы | Время, t, сек. |
| 10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. | ||
| 10 капель NH4CNS 0,5 н. 1 капля FeCl3, 0,5 н. 1 капля CuSO4, 1 н. |
Опыт 5 – таблица 6. Зависимость положения равновесия от состава системы
| № пробирки | Состав системы | Добавленный реактив | Наблюдения |
| ……..капель 0,0025н. FeCl3 ……..капель 0,0025 н. NH4CNS | нет | ||
| FeCl3 | |||
| NH4CNS | |||
| NH4Cl |
Обработка экспериментальных данных
Опыт 1
1. Заполнить таблицу 7.
Таблица 7
Зависимость скорости реакции от концентрации тиосульфата натрия
| № пробирки | С (Na2S2O3) (относительные единицы) | ln C отн = ln(Ci / C 1) | Время реакции t, с | Скорость реакции v = 1/τ, с−1 |
| 0,693 | ||||
| 1,10 |

2. По данным таблицы 7 построить график зависимости скорости реакции от концентрации тиосульфата натрия.
3. По данным таблицы 7 построить график зависимости в координатах ln C отн – t. Провести линию тренда – должна быть прямая зависимость. Определить тангенс угла наклона прямой. Значение тангенса угла наклона соответствует величине константы скорости реакции.
Как определять тангенс угла наклона!
Транспортиром не измерять!!!!!!!!!!
1. Выбрать на графике 2 точки подальше друг от друга.
2. По осям координат определить значения ln C отн и t для этих точек (см. рис.).
3.  .
.

 4. Составить кинетическое уравнение, учитывая, что порядок реакции по обоим реагирующим веществам равен 1.
4. Составить кинетическое уравнение, учитывая, что порядок реакции по обоим реагирующим веществам равен 1.
Опыт 2
1. По данным таблицы 3 заполнить таблицу 8.
Таблица 8
Зависимость скорости реакции от температуры
| № п/п | Температура T, K | Время реакции t, сек. | Скорость реакции v = 1/τ, с−1 | g | Ea, кДж/моль | |
| T 1 | g1 | Ea, 1 | ||||
| T 2 | ||||||
| g2 | Ea , 2 | |||||
| T 3 |
2. Значение температурного коэффициента (коэффициента Вант-Гоффа) рассчитать по формуле:
 ,
,
рассматривая попарно Т 2 − Т 1 и Т 3 − Т 2.
3. Значение энергии активации рассчитать исходя из формулы:
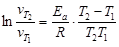 ,
,
рассматривая попарно Т 2 − Т 1 и Т 3 − Т 2.
4. Определить среднее значение коэффициента Вант-Гоффа gср.
5. Определить среднее значение энергии активации Ea , ср.
Содержание отчета по лабораторной работе
|
|
|
1. Название работы
2. Цель работы
3. Опыт 1
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 1 и таблица 2)
= обработка экспериментальных данных (таблица 7, графики, расчеты, значение константы скорости, кинетическое уравнение)
= вывод по опыту 1.
4. Опыт 2
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 3)
= обработка экспериментальных данных (таблица 8, расчеты)
= вывод по опыту 2
5. Опыт 3
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 4)
= написать уравнение соответствующей реакции. Почему скорость растворения мела в этих двух случаях различна?
= вывод по опыту 3
6. Опыт 4
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 5)
= Написать уравнения реакций взаимодействия хлорида железа (III) с тиоцианат калия, в результате которого образуется Fe(SCN)3 красного цвета и восстановления железа (III) в железо (II) тиосульфатом натрия, протекающую по уравнению:
2Fe(SCN)3 + 2Na2S2O3 = Na2S4O6 + 2Fe(SCN)2 + 2NaSCN
=Что являлось катализатором в данном опыте?
= вывод по опыту 4
7. Опыт 5
= название опыта
= экспериментальные данные (описание хода эксперимента, таблица 6)
= Написать уравнения реакции взаимодействия хлорида железа (III) с тиоцианатом калия, в результате которого образуется Fe(SCN)3 красного цвета;
= Как смещается равновесие при добавлении к реакционной системе хлорида железа и роданида аммония?
= Какой из реагентов больше смещает равновесие реакции в сторону образования продуктов реакции? Почему?
= Как влияет на положение равновесия добавление в систему тиоцианата аммония? В какую сторону смещается равновесие реакции?
= вывод по опыту 5
|
|
|


