 |
Обратимые химические реакции - это химические реакции, которые протекают одновременно в противоположных направлениях.
|
|
|
|
Обратимые химические реакции. Закон действия масс для обратимых реакций. Константа равновесия. Энергетическая схема обратимой реакции. Влияние изменения внешних условий(концентрации, давления, температуры, катализатора) на положение химического равновесия. Принцип Ле-Шателье.

Обратимые химические реакции - это химические реакции, которые протекают одновременно в противоположных направлениях.



Закон действующих масс для обратимых реакций, Константа равновесия
aA + bB = cC + dD

При достижении равновесия 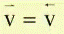

Если участники реакции - газы, то константа равновесия может быть записана через величины равновесных парциальных давлений.
Константа равновесия не зависит от концентраций реагентов, зависит от температуры.
Химическое равновесие
Химическое равновесие - состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. Это состояние сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении.
Химическое равновесие количественно характеризуется:
- Глубиной протекания процесса (степень диссоциации, степень гидролиза и т. п. )
- Величинами равновесных концентраций
- Константой равновесия
- Скоростью реакции при равновесии
Энергетическая схема обратимой реакции
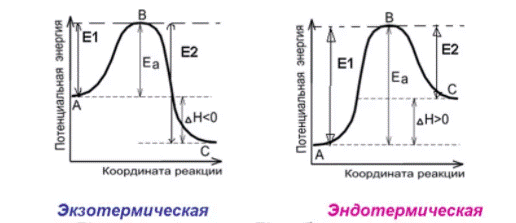
Влияние изменения внешних условий на положение химического равновесия
1. Концентрация
Увеличение концентрации исходных веществ смещает равновесие вправо
Увеличение концентрации продуктов реакции смещает равновесие влево, в сторону обратной реакции.
Системы пытается ослабить внешнее воздействие
|
|
|
Новое равновесие характеризуется новыми величинами равновесных концентраций и величинами скоростей прямой и обратной реакций, но постоянным значением константы равновесия (при Т=const)
2. Давление
При повышении давления равновесие сместится вправо (в сторону реакции, протекающей с уменьшением числа молей газообразных веществ (уменьшением объёма))
Если T=const, Kp=const, 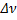 =0, давление не влияет на положение равновесия
=0, давление не влияет на положение равновесия
3. Температура

При изменении температуры меняются все количественные характеристики: константа равновесия, величины равновесных концентраций, величины скоростей прямой и обратной реакции.
4. Катализатор
Катализатор не изменяет положение равновесия, но ускоряет его достижение
Принцип Ле-Шателье
Если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Растворы электролитов.
Растворы электролитов
Вещества, растворы и расплавы которых проводят электрический ток, называются электролитами.
Электролитическая диссоциация
При растворении вещества могут распадаться на ионы. Ионы представляют собой заряженные атомы или группы атомов (сложные ионы)
Процесс распада вещества на ионы в растворах называется процессом электролитической диссоциации.
Сильные и слабые электролиты
Сила электролита определяется степенью диссоциации 

Количественные характеристики процесса электролитической диссоциации
1. Степень диссоциации - это доля частиц, подвергшихся электролитической диссоциации

2. Константа диссоциации




|
|
|


