 |
Расчет водородного показателя гидролизующихся солей
|
|
|
|
Расчет водородного показателя гидролизующихся солей



Факторы, влияющие на гидролиз:
● Концентрация
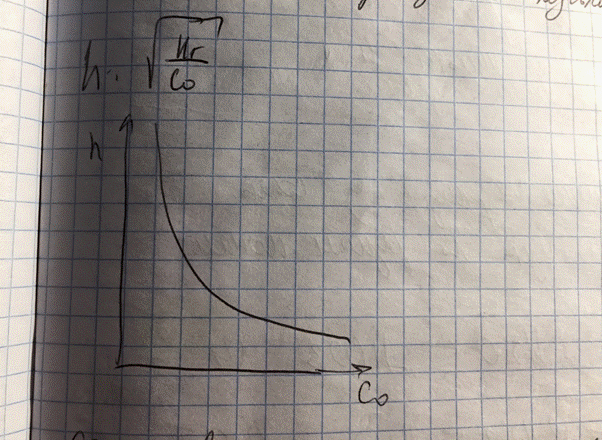
Рост концентрации приводит к подавлению гидролиза
● Температура
Реакция гидролиза - эндотермическая, а значит повышение температуры усиливает гидролиз
● Сила образованной кислоты или основания
Чем более слабый образуется электролит, тем меньше Константа диссоциации, а значит тем больше Константа гидролиза ===> гидролиз протекает полнее
● Образование малорастворимых или газообразных веществ
Na2S + 2H2O ⇔ NaOH + H2S↑
Равновесие смещается вправо ===> гидролиз усиливается
● Третий компонент
Добавление веществ, усиливающих c0, подавляют гидролиз
По катиону:
При добавлении кислоты равновесие смещается влево ===> подавление гидролиза
При добавлении основания равновесие смещается вправо ===> гидролиз проходит линейно
По аниону:
При добавлении кислоты равновесие смещается влево ===> усиление гидролиза
При добавлении основания равновесие смещается вправо ===> подавление гидролиза

ОВР-реакция с изменением степени окисления атомов элементов
ОВР можно записывать методом электронно-ионного баланса(полуреакций), где мы работаем с реальными частицами, и сильные электролиты записываются в виде ионов, а слабые в виде молекул
Окисление-процесс отдачи электронов
Восстановление-процесс принятия электронов
Окислитель -вещество, принимающее электроны(KMnO4, K2Cr2O7, H2SO4, HNO3, галогены, O2)
Восстановитель -вещество отдающее электроны(SO2, H2, галогеноводороды, металлы, C)
Типы овр
1)Межмолекулярного окисления-восстановления(разные вещества)
2)Внутримолекулярного ок-вос(1 вещество, но разные атомы)
|
|
|
2H2^(+1)O^(-2)---> 2H2^(0)+O2^(0)
3)Диспропорционирования(окислитель и восстановитель один и тот же элемент)
Cl^(0)+KOH------KCl(-1)+KClO(+1)+H2O

Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
К электролитам относят большинство неорганических соединений и растворимые соли органических кислот. Большинство органических соединений не проводят электрический ток и относятся к неэлектролитам.
Согласно теории электролитической диссоциации, предложенной С. Аррениусом, для количественной оценки диссоциации используют количественный показатель - степень диссоциации.
Степень диссоциации (∝ ) – это отношение числа частиц, распавшихся на ионы Nобщ к общему числу частиц, введенных в раствор Nдисс:

Степень диссоциации зависит от следующих факторов:
● от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т. к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т. е. гидратированных ионов.
● от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т. к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
По степени диссоциации электролиты делятся на сильные (∝ > 30%) и слабые (∝ < 30%).

Все растворимые соли ( в том числе соли органических кислот) являются сильными электролитам. Кроме того, электролитами являются растворы кислот и щелочей (растворимых оснований), при этом сила кислот и оснований зависит от степени диссоциации:

|
|
|


