 |
Определение
|
|
|
|
Определение
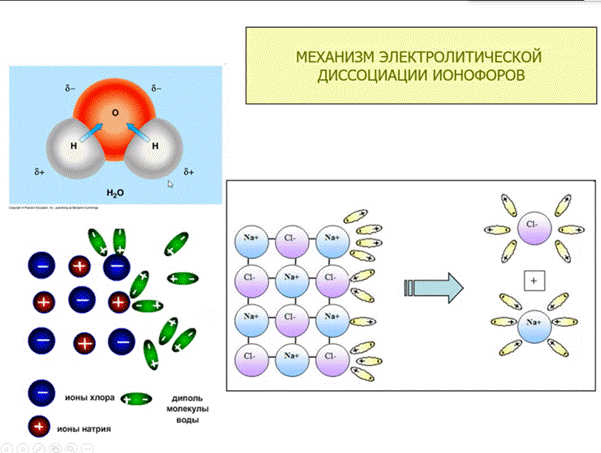
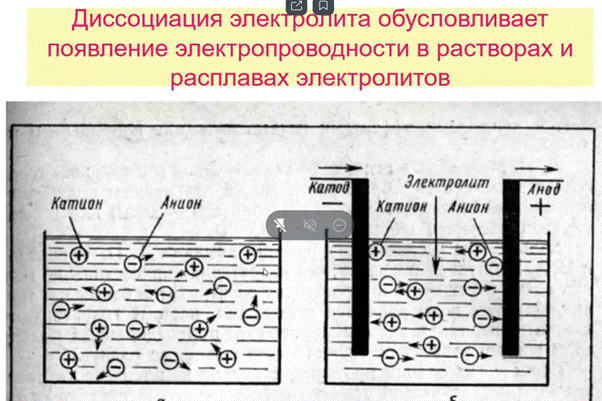
Сильные электролиты - это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. Степень диссоциации. стремится к единице (100%)
Сильные электролиты диссоциируют практически необратимо, поэтому в их водных растворах не содержится исходных молекул или негидратированных ионов, в уравнении диссоциации используют символ " "
Определение
Слабые электролиты - не полностью диссоциируют на ионы в водных растворах. Их степень диссоциации значительно меньше единицы, а в большинстве случаев стремится к нулю
Диссоциация слабых электролитов обратима, то есть одновременно с ней протекает и противоположный процесс – ассоциация, в уравнении используют символ " "
В растворах слабых электролитов преобладают не ионы, а недиссоциированные молекулы. Именно этим, например, объясняется, что растворы уксусной кислоты сохраняют запах даже при сильном разбавлении водой (обонятельные рецепторы реагируют на молекулы веществ, а не на ионы).
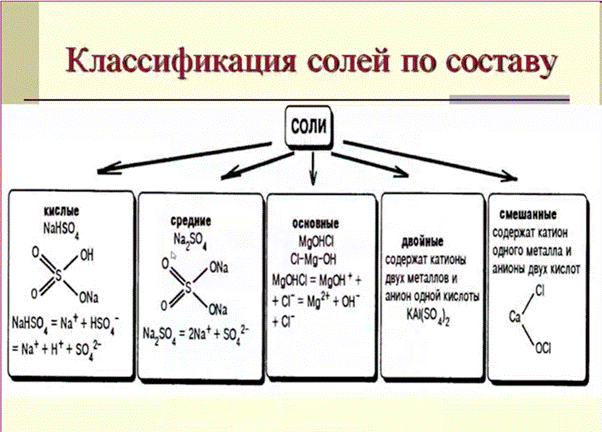
С точки зрения теории электролитической диссоциации можно рассматривать строение и свойства кислот, оснований и солей.












ЗАДАЧИ
1. Написать схему гидролиза и определить рН 0, 1М раствора К 3 РО 4, если
известно, что 1) гидролиз протекает по первой ступени; 2) константы
диссоциации ортофосфорной кислоты по первой, второй и третьей ступеням
соответственно равны К д1 =7, 910 -3; К д2 =110 -7; К д3 =4, 510 -12.
2. Рассчитать РН 2 %-ного раствора NаNО 2 (плотность раствора 1, 02 г/мл).
3. Написать схему гидролиза KF. Вычислить константу гидролиза KF.
Определить степень гидролиза этой соли в 0, 01М растворе и рН раствора, если
|
|
|
К д (НF) = 6, 610 -4.
4. Для растворения 1, 16 г PbJ 2 потребовалось 2 л воды. Найти ПР PbJ 2.
5. Растворимость карбоната серебра Ag 2 CО 3 в воде при 25 0 С равна 1, 16
мкмоль/л. Определить произведение растворимости этой соли в воде.
6. Выяснить, можно ли полностью растворить 7 г Zn(ОН) 2 в 1 л воды при
комнатной температуре, если известно, что произведение растворимости
гидроксида цинка при этой температуре равно 110 -17. Изменением объёма
раствора при растворении Zn(ОН) 2 пренебречь.
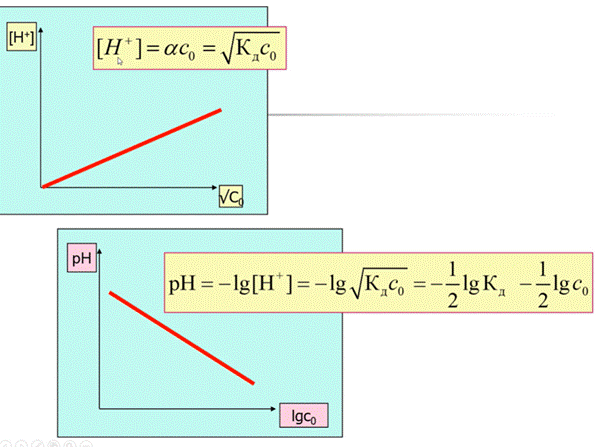
7. Определить степень диссоциации уксусной кислоты (СН 3 СООН) в 0, 1М
растворе, если константа диссоциации СН 3 СООН равна 1, 810 -5.
8. Сравнить рН 1М растворов уксусной кислоты (СН 3 СООН) и соляной
кислоты (HCl). К д (СН 3 СООН) = 1, 810 -5, Рассчитать степень диссоциации
уксусной кислоты.
9. Какую массу гидроксида натрия необходимо растворить в 3 л воды, чтобы
рН полученного раствора стал равен 11?
10. Константа нестойкости иона [Ag(CN) 2 ] - составляет 1, 4 · 10 -20. Вычислить
концентрацию ионов серебра в 0, 05М растворе K[Ag(CN) 2 ], содержащем,
кроме того, 0, 01 моля KCN в литре раствора.
11. Константа нестойкости иона [Cd(CN) 4 ] 2- составляет 7, 8 · 10 -18. Вычислить
концентрацию ионов кадмия в 0, 1 М- растворе K 2 [Cd(CN) 4 ], содержащем в
избытке 0, 1 моля KCN в литре раствора.
12. Во сколько раз уменьшится скорость реакции 2А(г)+В(г)С(г) при
уменьшении парциального давления всех веществ в системе в три раза и
одновременном понижении температуры системы на 30 0 С? Температурный
коэффициент скорости реакции =2.
13. Вычислите температурный коэффициент и энергию активации химической
реакции, если константа скорости этой реакции при 120 0 С равна 5, 8810 -4, а
при 170 0 С равна 6, 710 -2.
14. Во сколько раз увеличится скорость реакции, протекающей при 298 0 К,
если в результате использования катализатора удалось уменьшить энергию
активации на 4 кДж/моль?
15. Методом полуреакций составить уравнение ОВР, указать окислитель и
|
|
|
восстановитель. Рассчитать ЭДС, энергию Гиббса, сделать вывод о
направлении протекания при стандартных условиях химической реакции
H 2 S+ KMnO 4 +H 2 SO 4 S+ Mn SO 4 +….
16. Методом полуреакций составить уравнение ОВР, указать окислитель и
восстановитель. Рассчитать ЭДС, энергию Гиббса, сделать вывод о
направлении протекания при стандартных условиях химической реакции
A1 + NaOH + Н 2 О Na 3 [A1(OH) 6 ] + Н 2
17. Методом полуреакций составить уравнение ОВР, указать окислитель и
восстановитель. Рассчитать ЭДС, энергию Гиббса, сделать вывод о
направлении протекания при стандартных условиях химической реакции
KJ+K 2 Cr 2 O 7 +H 2 SO 4 J 2 +Cr 3+ +…
18. Вычислить изменение энергии Гиббса в реакции димеризации диоксида
азота 2NO 2 (г) N 2 O 4 (г) при стандартной температуре. Сделать вывод о
направлении протекания процесса, определить константу равновесия реакции
димеризации.
19. Какое количество тепла выделится при сгорании 8 г СН 4 при Р=1 атм и
Т=25°С.
20. При некоторой температуре равновесие в системе 2NO 2 2NO+O 2
установилось при концентрациях [NO]=0. 4 моль/л, [NO 2 ]=0. 2 моль/л, [O 2 ]=0. 1
моль/л. Найти константу равновесия и исходную концентрацию NO 2, если
исходная концентрация кислорода равна нулю. Какие условия будут
способствовать смещению равновесия в сторону образования NO, если прямая
реакция эндотермическая.
21. В какую сторону протекает реакция N 2(г) +3H 2(г) ↔ 2NH 3(г) в стандартных
условиях? Чему равна константа равновесия данной реакции?
22. Концентрация аммиака в замкнутом сосуде при 0 0 С равна 1 М. При
нагревании сосуда до 546 К давление внутри сосуда увеличилось в 3, 3 раза.
Определите константу равновесия реакции разложения аммиака при 546 К.
|
|
|


