 |
Диссоциация воды. pH + pOH = 14 T=298 K
|
|
|
|
Диссоциация воды
H2O 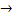 H+ + OH-
H+ + OH-
Kд(H2O)=[H+] [OH-]/[H2O]=1. 8*10^-16
[H2O]= 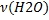 /V(H2O)=m(H2O)/M(H2O)V(H2O)=1000г/18 г/моль*1л=55, 56М
/V(H2O)=m(H2O)/M(H2O)V(H2O)=1000г/18 г/моль*1л=55, 56М
Константа ионного произведения воды:
Kw=[H+] [OH-]=1. 8*10^-16*55. 56=10^-14
Водородный показатель: pH=-lg[H+]
Гидроксильный показатель: pOH=-lg[OH-]
| Среда | [H+] | [OH-] |
| Нейтральная | [H+] = [OH-] = 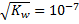
| pH=-lg10^-7=7 |
| Кислая | [H+] > [OH-] > 10^-7 | pH < 7 |
| Щелочная | [H+] < [OH-] < 10^-7 | pH > 7 |
lg Kw = lg([H+] [OH-]) = lg10^-14
lg[H+] + lg[OH-] = -14
-lg[H+] - lg[OH-] = 14
pH pOH
pH + pOH = 14 T=298 K
В растворах кислот и оснований, гидр солей Kw одинакова.
Расчет рН растворов сильных электролитов
В водных растворах и расплавах сильные электролиты практически полностью диссоциируют на ионы. Следовательно, в растворах сильных электролитов концентрация их ионов равна концентрации самого электролита с учетом числа ионов, образующихся при диссоциации молекулы электролита. Если известно молярная концентрация эквивалента вещества в растворе (С(f экв Х)), её нужно пересчитать в молярную концентрацию по формуле пересчета: С(Х) = С(f экв Х) · f экв (Х) = С(f экв Х) · 1/z
Расчет рН растворов слабых электролитов.
Слабые электролиты – электролиты, которые в водных растворах и расплавах не полностью (частично) диссоциируют на ионы. Для количественной характеристики полноты диссоциации введены понятия степени диссоциации (α ) и константы диссоциации (Кд) (диссоциация – процесс обратимый, к которому применим закон действующих масс). Чтобы определить концентрацию ионов в растворе слабого электролита, необходимо учесть степень диссоциации либо константу диссоциации слабого электролита:
С (иона) = С (слабого электролита) · α;
Кдисс С(иона) С(сл. эл. )
Следовательно, для раствора слабой кислоты:
|
|
|
рН = -lg C · α;
рН С Кд С Кд lg 0, 5 lg
Для раствора слабого основания:
рОН = -lg С · α;
рН = 14 + lg C · α;
рОН С Кд lg;
рН = 14 + 0, 5 lg C · Кд
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, α С = [X+] моль/л, и α C = [Y–] моль/л.
Если электролит сильный (α = 1), концентрация каждого из ионов просто равна исходной концентрации электролита. Например, в 1 литре 0, 1 М раствора NaCl содержится 0, 1 моль ионов Na+ и 0, 1 моль ионов Cl–.
К физическому смыслу произведения α С можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN 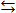 H+ + CN–
H+ + CN–
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H+] и n1 = [CN–]. В этом случае:
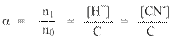
Отсюда следует, что
[H+] = Cα,
[CN–] = Cα.
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:
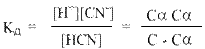
Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα ) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
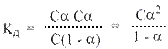
Или, в другой записи:
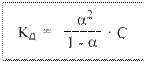
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора слабого электролита от концентрации раствора. Закон Оствальда справедлив для бинарных электролитов, т. е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
|
|
|
Однако в случае слабых электролитов величина (1 – α ) очень мало отличается от единицы. Действительно, если α = 0, 01, то (1 – 0, 01) = 0, 99, т. е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:
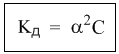
Константа диссоциации, как и любая константа равновесия, при данной температуре постоянна. Поэтому, если уменьшается концентрация вещества (раствор разбавляют), то для сохранения постоянства константы диссоциации должна возрастать величина α. Посмотрите опыт из Единой коллекции цифровых образовательных ресурсов: при разбавлении концентрированной уксусной кислоты раствор начинает слабо проводить ток (лампочка слегка накаляется). Это означает, что при разбавлении возрастает степень диссоциации слабого электролита. Наоборот, чем концентрирование раствор, тем меньше степень диссоциации α.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0, 1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1, 8·10–5. Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α 2С. Отсюда:
|
|
|
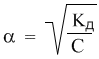
Подставляя в эту формулу численные значения, получим:
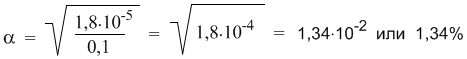
Эта же формула поможет нам количественно определить, как изменится степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0, 01 М. Отсюда:
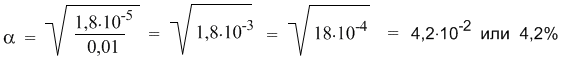
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.

Буферные растворы - содержат одновременно какую-либо кислоту и ее соль либо слабое основание и его соль и оказывают буферное действие.
Буферное действие - способность раствора поддерживать практически неизменным значение pH при их разбавлении и небольшом добавлении сильных кислот или щелочей.
Буферные растворы можно приготовить двумя способами:
1. Частичной нейтрализацией слабого электролита сильным электролитом: СН3СООН(избыток) + NaOH; NaOH(избыток) + HCl
2. Смешиванием растворов слабых электролитов с их солями (или двух солей): СН3СООН и СН3СООNa; NH3 и NH4Cl; NаН2РО4 и Nа2НРО4
Причина возникновения в растворах буферного действия –
заключается в совмещении нескольких протолитических равновесий В(основания) + Н+ ⇄ НВ+ (сопр. кислота)
НА(кислота) ⇄ Н+ + А- (сопр. основание)
Сопряженные кислотно-основные пары НВ+ /В и НА/А- называют буферными системами, которые представляют собой совмещенные равновесия процессов ионизации и гидролиза.
МЕХАНИЗМ:
1. Разбавление. При разбавлении водой концентрации кислоты и соли уменьшаются в одно и то же число раз, но соотношение lg С(соли)/С(кислоты) не меняется, поэтому рН буферного раствора практически не изменяется. Кроме того, рКкислоты или рКоснования не зависит от разбавления. 2. Добавление кислот и оснований. При добавлении в ацетатный буфер небольшого количества сильной кислоты ионы Н+ (образующиеся при ее диссоциации) связываются с ацетат-ионами, содержащимися в избытке, с образованием слабо диссоциирующих молекул СН3СООН. Степень диссоциации СН3СООН мала и концентрация [Н+ ] практически не меняется, рН буферного раствора уменьшится, но незначительно. 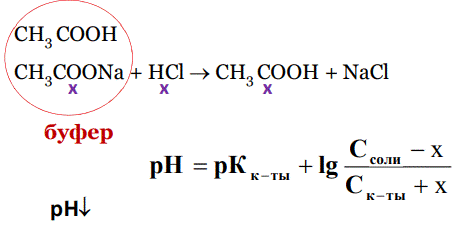
|
|
|
При добавлении небольшого количества NaOH, OHионы нейтрализуются кислотным компонентом буферного раствора, с образованием молекул воды. 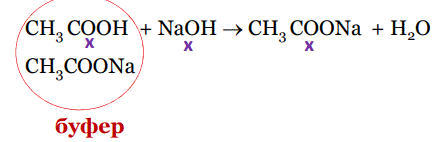
В результате добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания СН3СОО-, которое в меньшей степени влияет на реакцию среды. рН буферного раствора увеличивается, но незначительно.
БУФЕРНАЯ ЕМКОСТЬ:
- это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу. Буферная емкость зависит от соотношения компонентов и их концентрации
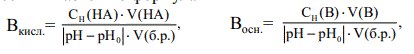
где V(HA), V(B) - объемы добавленных кислоты или щелочи, л.; Сн =(НА), Сн (В) – молярные концентрации эквивалента соответственно кислоты и щелочи; V(б. р. ) - объем исходного буферного раствора, л.; рНо, рН - значения рН буферного раствора до и после добавления кислоты или щелочи; |рН-рНо | - разность рН по модулю. , pH pH V(б. p. ) C (HA) V(HA) 0 H - × × Восн. =, pH pH V(б. p. ) C (B) V(B) 0 H - × ×
Буферная емкость по отношению к кислоте (Вкисл. ) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная емкость по отношению к основанию (Восн. ) определяется концентрацией (количеством эквивалентов) компонента с кислотными свойствами в буферном растворе.

Классификация буферных систем:
|
|
|


