 |
2.3. Окислительно-восстановительные потенциалы
|
|
|
|
2. 3. Окислительно-восстановительные потенциалы
Окислительно-восстановительным называют потенциал, возникающий на границе платинового электрода и раствора, содержащего окисленную и восстановленную форму вещества. Для примера рассмотрим платиновую пластину, погруженную в водный раствор солей FeCl2 и FeCl3.
Платина является инертным металлом и поэтому переход катионов платины в раствор невозможен.
Катионы Fe3+ являются окисленной формой по отношению к катионам Fe2+ и могут восстанавливаться, отбирая при этом электроны у платинового электрода и заряжая его положительно. Катионы Fe2+ являются восстановленной формой и отдают электроны платине, окисляясь до Fe3+. При достижении равенства скоростей процессов окисления и восстановления устанавливается химическое равновесие.
Суммарный окислительно-восстановительный потенциал зависит от концентрации как окисленной (Fe3+) так и восстановительной (Fe2+) формы катионов железа в растворе и определяются уравнением Нерства:
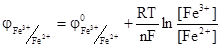
Стандартным окислительно-восстановительным потенциалом φ 0oх/red считают потенциал, возникающий на платиновом электроде, погруженном в раствор с концентрацией окисленной и восстановительной формы, равной 1 моль/л при температуре 298 К.
Измеряют величины стандартных окислительно-восстановительных потенциалов относительно стандартного водородного электрода. Некоторые значения φ 0oх/red приведены в таблице 2.
Таблица 2
| Электродная полуреакция | Потенциал, В |
| O2 + 2H2O + 2e = HO2- + OH- | 0, 076 |
| SO42- + 9H+ + 8e = HS- + 4H2O | 0, 252 |
| Cr2O72- + 14H+ + 12e = 2Cr + 7H2O | 0, 29 |
| O2 + 2H2O + 4e = 4OH- | 0, 401 |
| MnO4- + 2H2O + 3e = MnO2 + 4OH- | 0, 588 |
| J2 + 2e = 2J- | 0, 621 |
| Fe3+ + e = Fe2+ | 0, 77 |
| O2 + 4H+ + 4e = H2O (при рН=7) | 0, 815 |
| Br2 + 2e = 2 Br- | 1, 09 |
| O2 + 4H+ + 4e = 2H2O | 1, 229 |
| Cr2O72- + 12H+ +6e = CrOH2+ + 5H2O | 1, 26 |
| Cl2 + 2e = 2Cl- | 1, 39 |
| S2O82- + 2e = 2SO42- | 2, 01 |
|
|
|
2. 4. Направление окислительно-восстановительных реакций
Рассмотрим реакцию хлорида железа (III) с хлоридом олова (II), которая протекает по схеме:
2FeCl3 + SnCl2 = 2FeCl2 + SnCl4 (5)
Для предсказания возможности протекания данной реакции необходимо рассчитать величину изобарно-изотермического потенциала Δ G. Реакция протекает в сторону уменьшения свободной энергии Гиббса (Δ G < 0). Однако для окислительно-восстановительных реакций критерием направленности процесса могут служить величины окислительно-восстановительных потенциалов.
Представим реакцию (5) в виде:
Fe3+ + e = Fe2+
Sn2+ + 2e = Sn4+
Каждая из этих реакций характеризуется своим потенциалом
( 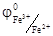 = 0, 771 В.
= 0, 771 В. 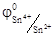 = 0, 153 В).
= 0, 153 В).
Так как перемещение электрона возможно от электрода с меньшим потенциалом к электроду с большим потенциалом, так и окислительно-восстановительная реакция протекает от меньшего значения окислительно-восстановительного потенциала к большему. На электроде с меньшим значением φ идет процесс окисления, а на электроде с большим значением φ – восстановления. Следовательно, в стандартных условиях катионы Fe3+ могут окислить катионы Sn2+, так как значение 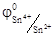 <
< 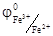
С увеличением концентрации катионов Sn4+ величина окислительно-восстановительного потенциала 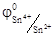 увеличивается, а с увеличением концентрации Fe2+ величина
увеличивается, а с увеличением концентрации Fe2+ величина 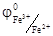 уменьшается. Окислительно-восстановительная реакция возможна до установления в системе равенства потенциалов. Таким образом, разность Δ φ (т. е. ЭДС) при стандартных условиях может служить критерием возможности протекания процесса. Окислительно-восстановительная реакция протекает в направлении от меньшего окислительно-восстановительного потенциала к большему до состояния равновесия. В этом же направлении изменяется (уменьшается) свободная энергия Гиббса, которая связана с изменением потенциала уравнением
уменьшается. Окислительно-восстановительная реакция возможна до установления в системе равенства потенциалов. Таким образом, разность Δ φ (т. е. ЭДС) при стандартных условиях может служить критерием возможности протекания процесса. Окислительно-восстановительная реакция протекает в направлении от меньшего окислительно-восстановительного потенциала к большему до состояния равновесия. В этом же направлении изменяется (уменьшается) свободная энергия Гиббса, которая связана с изменением потенциала уравнением
|
|
|
Δ G = -nFΔ φ
где n - число электронов,
F – число Фарадея.
|
|
|


