 |
4. Электролиз
|
|
|
|
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую. Процессы окисления и восстановления и в этом случае пространственно разделены: они протекают на разных электродах. На отрицательном электроде (катоде) происходит восстановление катионов, а на положительном электроде (аноде) – окисление анионов. Характер протекания электродных процессов при электролизе зависит от многих факторов: состава электролитов, материала электрода, режима электролиза (i, Т).
Различают электролиз расплавов и растворов электролитов. В качестве примера рассмотрим электролиз расплава бромида натрия. В расплаве соли бромида натрия NaBr существуют ионы Na+ и Br-. При подведении напряжения к электродам через расплав начнет протекать электрический ток.
Катионы Na+ подходят к катоду и восстанавливаются до металлического натрия, за счет электронов, поступающих к электроду от внешнего источника Na+ + е = Na. К аноду подходят бромид-ионы Br- и окисляются до Br2, отдавая электроны во внешнюю цепь 2Br- - 2е = Br2.
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных реакций и для бромида натрия она выразится уравнением:
|
 2Na+ + 2Br- 2Na + Br2
2Na+ + 2Br- 2Na + Br2
Электролиз водных растворов электролитов осложняется участием в электродных реакциях молекул воды, способных восстанавливаться на катоде (2Н2О + 2е = Н2 + 2ОН-, 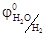 = -0, 41 В) и окисляться на аноде (2Н2О - 4е = О2 + 4Н+,
= -0, 41 В) и окисляться на аноде (2Н2О - 4е = О2 + 4Н+, 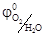 = 0, 814 В). На электродах возможно и разрядка ионов Н+ и ОН-, относительная концентрация которых определяется средой.
= 0, 814 В). На электродах возможно и разрядка ионов Н+ и ОН-, относительная концентрация которых определяется средой.
|
|
|
Из нескольких возможных параллельных электродных процессов будет протекать тот, осуществление которого требует меньшей затраты энергии. Критериями, определяющими преимущества того или иного электрохимического процесса, служат величины электродных потенциалов соответствующих равновесных систем.
В общем случае на аноде легче окисляются атомы, молекулы или ионы с наименьшим электродным потенциалом, а на катоде восстанавливаются те ионы, молекулы, атомы, потенциалы которых наиболее высокие.
Например, при электролизе нейтрального водного раствора NaI на катоде будут восстанавливаться молекулы воды, так как 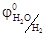 = -0, 41 В, а
= -0, 41 В, а 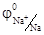 = -2, 71В. Окисляются же на аноде ионы I-, так как
= -2, 71В. Окисляются же на аноде ионы I-, так как 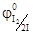 = 0, 536 В, а
= 0, 536 В, а 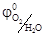 = 0, 814 В. Схематически это можно записать следующим образом:
= 0, 814 В. Схематически это можно записать следующим образом:
на катоде : в растворе: на аноде
← Na+ + I- →
← H2O →
2 Н2О + 2е- = Н2↑ + 2ОН 2I - 2е = → J2
|
 2NaI + 2 Н2О Н2↑ + I2 + 2NaОН
2NaI + 2 Н2О Н2↑ + I2 + 2NaОН
Для качественного предсказания результатов электролиза водных растворов электролитов можно руководствоваться следующими практическими правилами:
Для процессов на катоде:
1. В первую очередь восстанавливаются катионы металлов, имеющие электродный потенциал положительнее водородного (от Cu2+ до Au3+).
2. Катионы металлов, электродные потенциалы которых отрицательнее потенциала алюминия включительно, не восстанавливаются, на катоде идет восстановление молекул воды или ионов Н+.
3. При электролизе солей металлов, электродные потенциалы которых находятся между потенциалами алюминия и водорода, на катоде выделяются совместно как металлы, так и водород.
Если электролит содержит катионы различных металлов, то при электролизе восстановление их на катоде протекает в порядке уменьшения стандартного электродного потенциала соответствующего металла. Так из смеси Sn2+, Cu2+, Cr3+сначала будут восстанавливаться катионы меди, 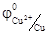 = 0, 34 В, затем катионы олова
= 0, 34 В, затем катионы олова 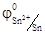 = -0, 136 В и, наконец, катионы хрома
= -0, 136 В и, наконец, катионы хрома  = -0, 744 В.
= -0, 744 В.
|
|
|
Для процессов на аноде:
Характер окислительных процессов зависит от материала электрода. Различаются нерастворимые (инертные) электроды и растворимые (активные) электроды. Инертные электроды изготовляются обычно из платины, графита, иридия. В процессе электролиза они служат лишь для передачи электронов во внешнюю цепь. При использовании инертных электродов:
1. в первую очередь окисляются анионы бескислородных кислот в порядке возрастания их φ (S-2, I-, Вr-, Cl-);
2. при электролизе водных растворов, содержащих анионы кислородосодержащих кислот (CO32-, NO3-, SO42-, PO43-), на аноде окисляются молекулы воды.
3. в щелочных растворах окисляются гидроксид-ионы:
4OH- - 4e → O2 ↑ + 2H2O
При использовании растворимых анодов (из меди, цинка, никеля, серебра и т. д. ) анодному окислению будет подвергаться сам материал анода:
Ме → Men+ + ne-
анод уходят уходят
в раствор во внешнюю цепь


 Так, например, при электролизе раствора сульфата меди с медным анодом происходит его растворение, поскольку потенциал системы
Так, например, при электролизе раствора сульфата меди с медным анодом происходит его растворение, поскольку потенциал системы
Cu Cu2+ + 2e-(0, 34 В) меньше потенциалов других возможных анодных процессов: 2SO42- - 2e S2O82- (2, 01 В) и 2Н2О – 4е О2 + 4Н+ (1, 23 В при рН < 7).
Как будет показано ниже, указанные правила не являются догмой, а руководством к действию и зачастую процессы на аноде и катоде осложняются, так как на практике электрохимические процессы проводят в условиях отличных от стандартных.
Рассмотрим несколько примеров электролиза водных растворов:
1. Как протекает электролиз раствора сульфата натрия с инертными электродами.
Схематически процесс можно представить так:

 Катод (Pt) р-р Na2SO4 Анод (Pt)
Катод (Pt) р-р Na2SO4 Анод (Pt)
← 2Na+ + SO42- →
← Н2О →
4Н2О + 4е- = 2Н2↑ + 4ОН- 2Н2О - 4е- = О2 + 4Н+
Из вышеприведенной схемы видно, что если катодное и анодное пространство будут разделены перегородкой, то в прикатодном пространстве будут накапливаться катионы Na+ гидроксид-анионы, образующиеся в результате восстановления воды. При упаривании воды из этого раствора может быть выделен NaOH. Около анода среда становится кислой, вследствие окисления воды, в результате чего в этой области накапливается серная кислота.
|
|
|
Если катодное и анодное пространства не разделены перегородкой, то ионы Н+ и ОН- образуют воду.
4Н+ + 4ОН- = 4Н2О
 Электролиз водного раствора Na2SО4 в конечном итоге сводится к электролизу воды, которая окисляется на аноде и восстанавливается на катоде.
Электролиз водного раствора Na2SО4 в конечном итоге сводится к электролизу воды, которая окисляется на аноде и восстанавливается на катоде.
2Н2О 2Н2↑ + О↑ 2
2. Как протекает электролиз водного раствора сульфата меди с применением электродов из меди.
Схематически процесс изобразится следующим образом:
 |
 Катод (Cu) р-р CuSO4 Анод (Cu)
Катод (Cu) р-р CuSO4 Анод (Cu)
← Cu2+ + SO42- →
← Н2О →
Cu2+ + 2е = Cu Cu - 2е = Cu2+
Медный анод растворяется, ионы меди Cu2+ перемещаются к катоду и там восстанавливаются до свободного металла. При равных площадях электродов количество соли в растворе остается неизменным: сколько меди растворяется на аноде, столько же ее восстанавливается на катоде.
|
|
|


