 |
3. Гальванический элемент
|
|
|
|
Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления.
Например, если из окислительно-восстановительных систем Zn2+/Zn и Cu2+/Cu составить электрохимическую цепь (цинковую и медную пластинки поместить соответственно в растворы ZnSO4 и CuSO4, разделенные диафрагмой), то получим гальванический элемент Даниэля-Якоби (рис. 3).
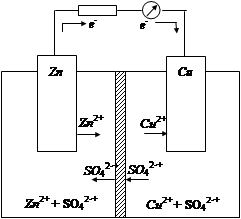 |
Рис. 3. Схема гальванического элемента Даниэля-Якоби
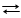
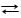 На границе раздела фаз металл – раствор возникает двойной электрический слой и устанавливаются равновесные электродные потенциалы, характеризующие равновесие для цинкового электрода
На границе раздела фаз металл – раствор возникает двойной электрический слой и устанавливаются равновесные электродные потенциалы, характеризующие равновесие для цинкового электрода
Zn Zn2+ + 2e и для медного электрода Cu Cu2+ + 2e.
Для внешней цепи этой электрохимической системы цинковый электрод станет отрицательным полюсом ( 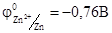 ), а медный – положительным (
), а медный – положительным ( 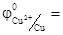 0, 34 В). Если замкнуть внешнюю цепь, то вследствие разности потенциалов цинка и меди, часть электронов с цинковой пластины перейдет на медную. Это нарушит равновесие в двойном слое у цинка (его потенциал повысится) и у меди (ее потенциал понизится). Изменение потенциала связано с изменением концентрации катионов металла у электродов. Обе системы Zn2+/Zn и Сu2+/Cu снова стремятся к равновесию за счет окисления цинка (Zn → Zn2++ 2e) и восстановление меди (Сu2++2е-→ Сu). Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая электрический ток в цепи. Во внутреннем участке цепи анионы SO42- перемещаются от медного электрода, где их избыток к цинковому, а катионы Zn2+ и Сu2+ - в обратном направлении, обеспечивая протекание ионного тока в растворе. Суммарный процесс выражается тем же уравнением реакции, что и при непосредственном взаимодействии окислительно-восстановительных систем Zn2+/Zn и Сu2+/Cu.
0, 34 В). Если замкнуть внешнюю цепь, то вследствие разности потенциалов цинка и меди, часть электронов с цинковой пластины перейдет на медную. Это нарушит равновесие в двойном слое у цинка (его потенциал повысится) и у меди (ее потенциал понизится). Изменение потенциала связано с изменением концентрации катионов металла у электродов. Обе системы Zn2+/Zn и Сu2+/Cu снова стремятся к равновесию за счет окисления цинка (Zn → Zn2++ 2e) и восстановление меди (Сu2++2е-→ Сu). Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая электрический ток в цепи. Во внутреннем участке цепи анионы SO42- перемещаются от медного электрода, где их избыток к цинковому, а катионы Zn2+ и Сu2+ - в обратном направлении, обеспечивая протекание ионного тока в растворе. Суммарный процесс выражается тем же уравнением реакции, что и при непосредственном взаимодействии окислительно-восстановительных систем Zn2+/Zn и Сu2+/Cu.
|
|
|
Zn + Сu2+ → Cu + Zn2+
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительный и восстановительный процессы оказываются разделенными пространственно: на положительном электроде (катоде) происходит процесс восстановления, а на отрицательном (аноде) – процесс окисления.
Необходимое условие работы гальванического элемента – разность потенциалов электродов. Наибольшего значения работа гальванического элемента достигает при изотермическом обратимом проведении реакции. В этом случае разность потенциалов максимальна и называется электродвижущей силой гальванического элемента (ЭДС). При схематической записи гальванического элемента границу раздела между металлом и раствором обозначают одной вертикальной чертой, а границу раздела между растворами – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
Zn Zn2+ Cu2+ Cu
ЭДС элемента (Е) равна разности электродных потенциалов Cu и Zn. Так как ЭДС величина положительная, то для ее расчета от потенциала катода вычитают потенциал анода (Е = jCu2+/Cu - jZn2+/Zn = 1, 1 В).
Измерить ЭДС элемента можно скомпенсировав ее от внешнего источника (противоположно направленной ЭДС) – компенсационным методом (рис. 4). Перемещая подвижный контакт К, можно подобрать такое положение на потенциометре, при котором ток в цепи будет отсутствовать и в системе у электродов достигается равновесие, т. е. создаются условия, необходимые для протекания обратимых полуреакций и электрическая работа элемента будет максимальна. Следовательно, падение напряжения на участке АК и есть ЭДС гальванического элемента.
|
|
|
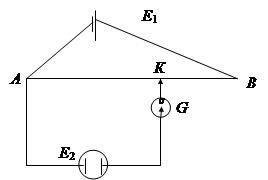 |
Рис. 4. Схема компенсационного измерения ЭДС
Е1 – внешний источник
Е2 – гальванический элемент, АВ – потенциометр
К – подвижный контакт, Г – гальванометр.
Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое входное сопротивление.
В рассмотренном элементе Даниэля-Якоби материал электрода сам участвует в окислительно-восстановительных реакциях. Такие элементы называются элементами с активным электродом. В окислительно-восстановительных гальванических элементах синертными электродами металл электрода служит лишь передатчиком электронов. Например,
Pt Sn2+, Sn4+ Fe3+, Fe2+ Pt
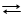
 Один полуэлемент (электрод) представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод. На поверхности электрода устанавливается равновесие
Один полуэлемент (электрод) представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод. На поверхности электрода устанавливается равновесие
Sn2+ Sn4++ 2е, которое определяет потенциал электрода (в стандартных условиях) 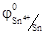 = 0, 15 В). В другом полуэлементе платиновый электрод погружается в раствор смеси солей Fe3+ и Fe2+ (например, FeCl3 и FeCl2). На его поверхности устанавливается равновесие Fe2+ Fe3+ + е, характеризуемое в стандартных условиях потенциалом
= 0, 15 В). В другом полуэлементе платиновый электрод погружается в раствор смеси солей Fe3+ и Fe2+ (например, FeCl3 и FeCl2). На его поверхности устанавливается равновесие Fe2+ Fe3+ + е, характеризуемое в стандартных условиях потенциалом 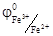 = 0, 77 В. Следовательно, при замыкании внешней цепи, состоящей из этих двух полуэлементов, один из них будет выступать анодом (Pt/Sn4+, Sn2+), а второй – катодом (Fe3+, Fe2+/Pt) и Е = 0, 77 В – 0, 15 = 0, 62 В.
= 0, 77 В. Следовательно, при замыкании внешней цепи, состоящей из этих двух полуэлементов, один из них будет выступать анодом (Pt/Sn4+, Sn2+), а второй – катодом (Fe3+, Fe2+/Pt) и Е = 0, 77 В – 0, 15 = 0, 62 В.
Необходимую для работы гальванического элемента разность потенциалов можно создать, используя одинаковые электроды и один и тот же раствор, но разной концентрации разной концентрации. В этом случае гальванический элемент называется концентрационным и работает он за счет выравнивания концентраций растворов.
Zn Zn2+ Zn2+ Zn
а| = 0, 1моль/л а|| = 0, 001моль/л
Е = jК - jА = 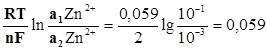
|
|
|


