 |
4.1. Напряжение разложения электролита. Поляризация электродов
|
|
|
|
Протекание электрического тока через электрическую ванну приводит к сдвигу потенциалов от их равновесных значений, отвечающему определенной плотности тока, т. е. к поляризации электродов.
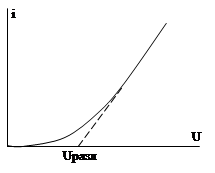 Рассмотрим электролиз 0, 1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1, 3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рассмотрим электролиз 0, 1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1, 3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рис. 6. Зависимость силы тока от напряжения при электролизе
При электролизе водного раствора серной кислоты это напряжение –1, 7 В, а для раствора сульфата натрия –2, 3 В. То есть каждому электролиту свойственно определенное минимальное напряжение, которое необходимо приложить к раствору, чтобы начался электролиз. Такое необходимое напряжение получило название «напряжение разложения» (Uразл. ).
Это объясняется тем, что катодный и анодный процессы
2Н+ + 2е = Н2 (на катоде)
2Cl- - 2е = Cl2 (на аноде) для раствора НCl сопровождаются химической поляризацией электродов, обусловленной превращением катода в водородный электрод а анода в хлорный с соответствующими потенциалами (рис. 7).
 |
Рис. 7. Поляризационные кривые, иллюстрирующие процессы при электролизе раствора HCl с платиновым электродом
В результате химической поляризации электродов возникает гальванический элемент, электродвижущая сила которого равна Епол = 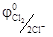 -
- 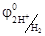 = 1, 36 – 0, 000 = 1, 36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
= 1, 36 – 0, 000 = 1, 36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
|
|
|
Таким образом, в общем случае напряжение, при котором будет происходить электролиз (напряжение разложения), складывается из ЭДС поляризации (Епол = φ k – φ А), анодного и катодного перенапряжения (η A и η k), омического падения напряжения на электролите (Δ Uэл).
Uразл = Епол + η а + η к + Δ Uэл
Перенапряжение для катодных реакций, в процессе которых выделяются металлы, обычно невелико. Так, для меди и цинка η k достигает несколько десятков милливольт. Ртуть, серебро, олово, свинец выделяются из водных растворов солей почти без перенапряжения. Наибольшее перенапряжение достигается у металлов семейства железа, доходя до нескольких десятых долей вольта. Очень велико перенапряжение при выделении водорода (водородное перенапряжение). Оно очень сильно зависит от природы катода и состояния его поверхности. Эта зависимость отражена в константе «а» уравнения Тафеля (η = а + blgi). Постоянная «b» при 20˚ С для всех металлов ≈ 0, 12 В. В кислых растворах при i = I A/см2 величина «а» для разных металлов имеет следующие значения: платина – 0, 1 В; железо – 0, 7 В; медь – 0, 87 В; олово – 1, 2 В; цинк – 1, 24 В; свинец – 1, 56 В; ртуть – 1, 47 В. Это делает возможным при электролизе водных растворов разряд ионов тех металлов (Ni, Cd, Cr, Zn и др., вплоть до Mn), потенциалы которых оказываются в соответствующих условиях более электроотрицательными, чем потенциал водородного электрода (рис. 8). Благодаря этому получили широкое распространение методы электроосаждения металлов: например, электролитическое хромирование, цинкование, никелирование, лужение. На ртутном катоде из нейтральных водных растворов удается восстановить даже натрий.
|
|
|
Протекание анодных реакций часто сопровождается выделением газов и для них характерно также высокое перенапряжение, особенно для кислорода η О2 = 1, 5 В. Из-за большого кислородного перенапряжения в случае электролиза раствора NaBr или HCl на платиновом аноде выделяются Br2( 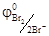 = 1, 06 В) и Cl2 (
= 1, 06 В) и Cl2 ( 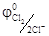 = 1, 36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0, 81 В и 1, 23 В).
= 1, 36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0, 81 В и 1, 23 В).
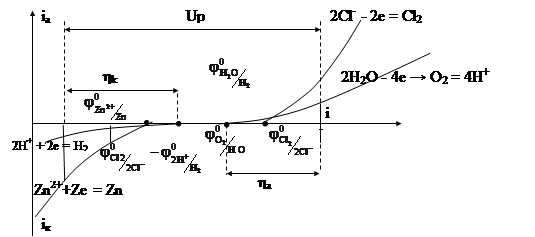 |
Рис. 8. Поляризационные кривые, иллюстрирующие процессы при электролизе водного раствора хлорида цинка с графитовыми электродами
Водородное и кислородное перенапряжение имеет большое прикладное значение и должно учитываться при электролизе водных растворов. Их роль в процессах очень различна. Она негативна, например, при промышленном получении кислорода и водорода электролитическим способом, так как перенапряжение связано с дополнительным расходом электроэнергии в этом случае и, позитивна при электролитическом получении металлических покрытий, при зарядке кислотных аккумуляторов и т. д.
|
|
|


