 |
Лептин - главный регулятор энергетического обмена.
|
|
|
|
Ф-и лептина:
+поддерживает энергетическое равновесие между избавлением и пополнением нужного количества калорий;
+посылает сигнал головному мозгу о состоянии жировой ткани;
+адаптирует организм к ощущению голода;
+корректирует количество употребляемой еды;
+отвечает за повышение энергетической траты;
+предупреждает использование внутриклеточных жиров;
+повышает количество глюкозы в крови до нужного уровня;
+совместно с работой половых органов девушки отвечает за своевременное половое +созревание, регулирует временные рамки отдельных его периодов;
+повышает до нормы артериальное давление;
+контролирует чувствительность тканей к выработке инсулина.
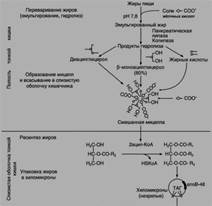
БИЛЕТ 21)Схема переваривания пищевых липидов в ЖКТ: этапы, субстраты, ферменты, роль продуктов гидролиза, роль жёлчных кислот. Ресинтез липидов в энтероците.
Жиры составляют до 90% липидов, поступающих с пищей. Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием "липазы языка".
Так как жиры - нерастворимые в воде соединения, то они могут подвергаться действию ферментов, растворённых в воде только на границе раздела фаз вода/жир. Поэтому действию панкреатической липазы, гидролизующей жиры, предшествует эмульгирование жиров. Эмульгирование (смешивание жира с водой) происходит в тонком кишечнике под действием солей жёлчных кислот. Жёлчные кислоты синтезируются в печени из холестерола и секретируются в жёлчный пузырь. Жёлчные кислоты представляют собой в основном конъюгированные жёлчные кислоты: таурохолевую, гликохолевую. Жёлчные кислоты действуют как детергенты, располагаясь на поверхности капель жира и снижая поверхностное натяжение. В результате крупные капли жира распадаются на множество мелких, т.е. происходит эмульгирование жира. Эмульгирование приводит к увеличению площади поверхности раздела фаз жир/вода, что ускоряет гидролиз жира панкреатической липазой. Эмульгированию способствует и перистальтика кишечника.
|
|
|
Панкреатическая липаза выделяется в полость тонкой кишки из поджелудочной железы вместе с белком колипазой. Колипаза попадает в полость кишечника в неактивном виде и частичным протеолизом под действием трипсина превращается в активную форму. Колипаза своим гидрофобным доменом связывается с поверхностью мицеллы эмульгированного жира. Другая часть молекулы способствует формированию такой конформации панкреатической липазы, при которой активный центр фермента максимально приближен к своим субстратам - молекулам жиров, поэтому скорость реакции гидролиза жира резко возрастает.
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, иногда могут использоваться и эндогенные жирные кислоты. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это ликвидирует их детергентное действие на мембраны и позволяет переносить по крови в ткани.
БИЛЕТ 22)Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления С16:0. Регуляция процесса β-окисления ВЖК. Особенности обмена липидов в нервной ткани.
β-Окисление – аэробный процесс катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА.
Ок-нию жирных к-т предшествует:
а.активация ВЖК в цитоплазме;
б.транспорт ее через мембрану в матрикс митохондрий.
Цикл бета-ок-ния состоит из 4 р-й:
|
|
|
1.Р-я дегидрирования (ф-нт ацил-КОА-дегидрогеназа) присходит отщепление 2х атомов водорода с образ транс-еноил-КОА и вос-ный ФАДН2.
2.Р-я гидратации (ф-нт гидратаза) образ L-3-гидроксиацил-КОА.
3.Р-я дегидрирования (ф-нт 3-гидроксиацил-КОА-дегидрогеназа, кофермент – НАД+) в ходе р-и образ 3-кетоацил-КОА.
4. Тиолитическое расщепление (ф-нт тиолаза) 3-кетоацил-КОА расщепляется на ацетил-SКОА и укороченный ацил-SКОА.
Энергетический эффект полного окисления С16:0 в ходе 4 последовательных этапов образ:
1.бета-ок-ние: 35 АТФ
2.ЦТК: 12 АТФ
3.ок-ное фосфорилирование: 96 АТФ
Итого: 35+96 – 1 = 130 АТФ (1 АТФ на активацию ВЖК)
Регуляция бета-ок-ния осущ на этапе транспорта жирных к-т через мембрану митохондрии (регуляторный ф-нт карнитинацилтрансфераза-1).
Для нервной ткани характерно альфа-ок-ние ВЖК. Тк при этом ок-нии от углеводородной цепи отщепляется по одному атому углерода в виде СО2.
БИЛЕТ 23) 1.Анаэробный гликолиз- процесс расщепления глю с образованием лактата.Протекает без О2,не зависит от работы митохондрий и АТФ образуется за счет субстратного фосфорилир.Характерен для мышц и эритроцитов.Главная функция-энергетическая.
Стадии: 1)глю->глю-6-ф(-1 АТФ)2)->фруктозо-6-ф(-1 АТФ)3) ->фруктозо-1,6-бисф 4-5) (образуются 2 соединения)->дигидроксиацетонфосфат и 2 трифосфоглицероальдегид(р-ия сдвинута в его сторону,поэтому из него далее образуется: 6) 2 мол 1,3-бисфосфоглицерат(образуется 2НАДН+Н,который используется в 11 р-ии) ->7)2 мол 3-фосфоглицерат(образуется 2 АТФ) 8)2 мол 2-фосфоглицерат-> 9)2 мол фосфоенолпируват(-вода) ->10)2 пируват(образуется 2 АТФ) ->11) ->2 лактат(образует НАД).Лактат ->в кровь->захватывается гепатоцитами-> и используется для биосинтеза глю.Также может захватываться кардиоцитами для получения АТФ в миокарде.
Суммарное ур-ие:С6Н12О6+2Н3РО4+2АДФ->2С3Н6О3+2АТФ+2Н2О
Цикл Кори (глюкозо-лактатный цикл) -биохимический транспорт лактата из мышц в печень и дальнейший синтез глюкозы из лактата, катализируемый ферментами глюконеогенеза.Лактат может захватываться кардиоцитами для получения АТФ в миокарде.Используетс я скелетной мускулатурой при интенсивной работе.
(2 лактата из мышц-> в кровь->в печень->ПВК->глю(-6 АТФ) ->глю в кровь->в мышцы->ПВК(= 2 АТФ) ->лактат.Цкл замыкается)Цикл обеспечивает утилизацию лактата и предотврает его накопление.
|
|
|
БИЛЕТ 24) Кетоновые тела (ацетоацетат, в-гидроксибутират,ацетон) при голодании, длительной физической работе, когда клетки не получают достаточного количества глюкозы используются многими тканями как основной источник энергии.
Синтез в матриксе МХ:субстрат-ацетил –КоА липидного или а/к происхожд-ия.
Стадии:1) Конденсация 2 молекул ацетил –КоА->ацетоацетат-КоА(ф-трансфераза) 2) ацетоацетат-КоА+ ацетил –КоА+Н2О->ГМГ-КоА(ф-ГМГ-КоА-синтетаза) 3) ГМГ-КоА->ацетоацетат+Ацетил-КоА(в ЦТК)(ф-ГМГ-КоА-лиаза). Ацетоацетат:1.может превратиться в в-гидроксибутират(ф-в-гидроксибутиратДГ); 2.спонтанное декарбоксилирование ->ацетон.
В норме обнаруживаются в следовых кол-во. В крови-0,03-0,2 ммоль/л, в моче-20-5- мг в сутки. Увеличение концентрации кетоновых тел в крови - кетонемией, выделение кетоновых тел с мочой - кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва, а в тяжёлых случаях - к сдвигу рН.
Фазы голодания: Первая фаза продолжается сутки. За это время исчерпываются запасы гликогена. Концентрация инсулина в крови уменьшена в 10 – 15 раз по сравнению с периодом пищеварения, концентрации глюкагона и кортизола повышены. Это приводит к увеличению скорости мобилизации жиров и скорости глюконеогенеза из аминокислот и глицерола. Концентрация глюкозы в крови находится на уровне нижней границы нормы за счет глюконеогенеза.длится неделю. Вторая фаза длится примерно неделюЭнергетические потребности мышц и органов удовлетворяются за счет жирных кислот и кетоновых тел. Так как концентрация инсулина в крови при голодании очень низкая, то в этих условиях потребителями глюкозы становятся только инсулинонезависимые клетки, в первую очередь, клетки головного мозга. Третья фаза продолжается несколько недель. Скорость распада белков стабилизируется на уровне 20 г/сутки. При этом образуется примерно 5 г мочевины в сутки, в то время как при обычном питании – 20 – 25 г мочевины в сутки.По мере увеличения продолжительности голодания нарастает атрофия тканей: через 4 – 8 недель голодания масса сердечной мышцы и мозга уменьшаются на 3 – 4%, скелетных мышц – на 1/3, а печени – вдвое. После израсходования 1/3 – ½ всех белков наступает смерть.
|
|
|
БИЛЕТ 25 ) Синтез ТАГ: субстраты:ацил-КоА и а-ГФ,в кишечнике-в-МАГ
этапы:1)Этерификация ОН групп а-ГФ двумя ацил-КоА->фосфатидная кислота(ф-ацилтрансфераза) 2)гидролиз фосфатидной кислоты-> 1,2-ДАГ(ф-фосфотаза) 3)ацилирование 1,2-ДАГ->ТАГ(ацилтрансфераза)
Особенности синтеза в печени(П)и жир. тк(Ж).: в период приема пищи в П и Ж инсулин стимулирует синтез ТАГ.Для этого необходим ацетил-КоА.Инсулин стимулирует утилизацию глюпеченью,в печень поступает много глю в рез-те активируется гликолиз и ЦТК,в рез-те накапливается цитрат,который переходит в цитозоль и расщепляется на ацетил-КоА и ОАА и активирует ф-ацетил-КоА-карбоксилазу,которая активирует малонил-КоА,который блокирует активность регуляторного ф. в-окисления-карнитинацилтрансферазу-1,а сам включается в биосинтез жирных кислот.
В рез-те действия инсулина->увеличевается синтез ТАГ и секреция их в кровь в составе ЛПОНП -> доставляют ТАГ из печени в капилляры жир. тк.,где инсулин индуцирует синтез липопротеинлипазы.ЛП-липаза переносится на эндотелий капиляров жир. тк.,где осуществляется гидролиз ТАГ.Одновременно инсулин активирует ГЛЮТ-4 в адипоцитах->поступление глю в адипоциты увеличивается->активируется гликолиз в процессе которого образуются компоненты для синтеза ТАГ.
Синтез ГФЛ: (фосфатидилхолинов, фосфатидилэтаноламинов и фосфатидилсеринов) Начальные этапы происходят с образованием фосфатиднойкислоты.На следующем этапе фосфатидаза отщепляет от фосфатидной кислоты фосфатный остаток-> образуется диацилглицерол. Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов - образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в ЦДФ-холин, ЦДФ-серин или ЦДФ-этаноламин.Далеедиацилглицеролвзаимодействует с ЦМФ-производными, при этом выделяется ЦМФ, и образуется соответствующий фосфолигщц, например фосфатидилхолин. Между глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM. Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования. Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на серии.
Сурфактант: -внеклеточный липидный слой с небольшим количеством гидрофобных белков, выстилающий поверхность лёгочных альвеол и предотвращающий слипание стенок альвеол во время выдоха.Основной компонент - Дипальмитоилфосфатидилхолин, составляющий до 80% от всех фосфолипидов, входящих в состав сурфактанта.Синтездипальмитоилфосфатидилхолина (лецитина) в пневмоцитах II типа происходит в процессе эмбрионального.Важным показателем нормального формирования сурфактанта служит соотношение фосфатидилхолин/сфингомиелин>4 Соотношение фосфатидилхолин/сфингомиелин<2 указывает на высокий риск развития респираторного дистресс-синдрома. В случае необходимости лечение беременных кортикостерридами стимулирует синтез сурфактанта в лёгких плода и уменьшает риск развития респираторного дистресс-синдрома.
БИЛЕТ 26) Биосинтез ХС в клетках печени, тонкого кишечника и кожи осуществляется из АцКоА, который освобождается в результате распада белков, липидов и углеводов.Эндогенный ХС синтезируется преимущественно в печени (85%), в небольшой степени в тонком кишечнике (10%) и коже (5%).
В организме человека ХС выполняет следующие функции:1. структурная – ХС является структурным компонентом биомембран клеток. Принимает участие в регуляции их проницаемости, регулирует активность ферментов, работу рецепторов и переносчиков биомембран;2. метаболическая – связана с тем, что ХС является предшественником стероидных гормонов (андрогены, эстрогены, минерало- и глюкокортикоиды), витамина D3 и желчных кислот.
Процесс б иосинтеза ХС:Источником биосинтеза ХС является ацетил-КоА,
2 ацетил-КоА (2 углеродных атома) ®(ацетил-КоА-тиолаза) ацетоацетил-КоА (4С) ®(гидроксиметилглутарил-КоА-синтетаза, +АцКоА) b -гидрокси- b -метилглутарил-КоА (6С) ®(редуктаза) 5 мевалоновая кислота (6С) ®(конденсация) сквален (30С) ®(циклизация) ланостерин (30С) ®(происходит деметилирование и перемещение двойной связи в кольце, -3СН3) холестерин (27С)
Освободившийся в результате распада клеток, ХС с помощью ЛПВП транспортируется в печень, где при участии цитохрома Р450 окисляется с образованием желчных кислот.примерно 80% окисленного ХС выводится с желчными кислотами через кишечник в виде капостеринов.
Кальцитриол является метаболитом витамина D3,имеет стероидную природу. Синтез происходит в три этапа:1)протекает в коже, где под влиянием УФ лучей из провитамина образуется витамин D3 или холекальциферол2)связан с печенью, куда холекальциферол транспортируется кровью и где в эндоплазматическом ретикул 'мегепатоцитов происходит его гидроксилирование по 25-му атому углерода с образованием 25(OH)D3. Этот метаболит поступает в кровь и циркулирует в связи с альфа-глобулином. Его физиологические концентрации не влияют на обмен кальция. 3-3)осуществляется в почках, где в митохондриях клеток проксимальных канальцев происходит второе гидроксилирование и образуются два соединения: l,25-(OH)2-D и 24,25-(OH)2-D.
Основной эффект -заключается в активации всасывания кальция в кишечнике. Действие кальцитриола на эпителиальные клетки кишечника состоит в индуцировании синтеза энтероцитами специальных кальций-связывающих и транспортирующих белков — кальбайндинов. Кальцитриол повышает в кишечнике и всасывание фосфатов. Почечные эффекты гормона заключаются в стимуляции реабсорбции фосфата и кальция канальцевым эпителием. Эффекты кальцитриола на костную ткань связаны с прямой стимуляцией остеобластов и обеспечением костной ткани усиленно всасывающимся в кишечнике кальцием, что активирует рост и минерализацию кости.
Недостаточность кальцитриола проявляется в виде рахита, т. е. нарушения созревания и кальцификации хрящей и кости у детей, либо остеомаляции, т. е. падения минерализации костей после завершения роста скелета. При этом сдвиги уровня кальция в крови и клетках обусловливают угнетение нейромышечной возбудимости и мышечную слабость.
|
|
|
БИЛЕТ 27) ПОЛ — цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления. Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидовжирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению.
Ферментативная рег-ияПОЛ-включает 3 линии: 1)супероксиддисмутаза(СОД)+каталаза;2)глутатионпероксидаза(ГПО)+глутатионредуктаза(ГР); 3)церулоплазмин+трансферин
хар-ка этапов: 1)СОД( мембранный фермент;каталитическую активность ф. обеспечивает Cu2).СОД- превращает супероксидные анионы в перекись водорода:2О ∙ 2 + 2H+ → H2O2+ O2; Каталаза - катализирует реакцию разрушения перекиси водорода:2Н2О2 → H2O+ O2.Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления.
2)ГПО — обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (содержится во всех клетках): Н2О2 + 2 GSH → 2 Н2О + G-S-S-G. ГПО в качестве кофермента содержит селен;
ГР- восстанавливает окисленный глутатион с участием НАДФН2: GS-SG + НАДФН2 → 2 GSH + НАДФ+. 3) Церулоплазмин -белок плазмы(острой фазы при воспалении), в АЦ содержит Cu2+ ,окисляет железо:ЦП-Cu2++Fe2+àЦП-Cu+Fe 3+; ЦП-ингибирует ПОЛ на стадии разветвления цепи,т к окисляет железо. Трансферрин-плазм. белок,обеспеч. связывание и транспорт Fe3+ в депо.
Неферментативная защита: Природные:1) Витамин Е (α-токоферол)-мембранный антиоксидант,содержится в семенной жидкости и развивающихся клетках.В основе действия-взаимодействие с радикалами,образующимся в цепи окисления жирных кислот,восстанавливает их,а сам превращается в стабильную окисленную форму — токоферолхинон. 2)Витамин С- восстанавливает в мембранах токоферолхинон до витамина Е; взаимодействует с активными формами кислорода — О ∙ 2, Н2О2, НО ∙ и инактивирует их.; 3)амины; 4) HS-соединения(глутатион,метионин,цистеин)-являются инактиваторамигидроперекисных радикалов ЖК.; 5)Многоатомпные спирты(сорбит,ксилол,манит)-связывают свобод радикалы и АФК за счет своих ОН-группю;6)комплексообразователи-образовывают координационные связи с ионами железа,образуя комплексные соли.; 7)мембрана-явл структурным антиоксидантом. Синтетические:1) антирадикальные о орг в-ва-выступают в роли конкурентов субстратов ПОЛ 2)ионол,дибунол
БИЛЕТ 28) Креатинин образуется из креатина – азотистого соединения мышечной ткани. Креатин синтезируется в печени из АК: АРГ, МЕТ, ГЛИ. Затем креатин поступает в мышцу, где связывает фосфат с образованием креатинфосфата. Иногда креатинфосфат "теряет" фосфат, тогда образуется креатинин – конечный продукт распада.
Количество креатинина в моче определяется как показатель клубочковой фильтрации почек (он не реабсорбируется).;Креатинфосфат-обеспечивает энергией мышцу в начальный период работы.
Фибриллярные белки:Миозин(54%)(толстая нить)-отличается большим содержанием глутаминовой кислоты. Имеет отрицательный заряд. Он связывает ионы Са++ и Mg++. В присутствии Са++ миозин обладает активностью АТФ-азы. В присутствии Mg++ миозин связывает АТФ и АДФ. Способен взаимодействовать с актином.;Актин (тонкая нить) (25%)-Имеет три формы: мономерная форма: G–актин (глобулярная структура, глобулы полярные), связывается с АТФ;димерная;полимерная.;Актомиозиновый комплекс обеспечивает сокращение мышц. Регуляторные белки: 1) тропомиозин(7%)- представляет собой две a- спирали (своеобразные нити). Он соединяется с тропонином и этот комплекс присоединяется к актину.;2)тропонин(2%)- глобулярный белок нескольких видов. Выделяют: TN-C, TN-I, TN-T.TN-T связывается с тропомиозином, TN-I – ингибитор АТФ-азы, TN-C связывается с Ca++.3)а,в-актинин-обеспечивает надлежащую упаковку филаментов в саркомере.
Механизм мышечного сокращения: происходит за счет проникновения нитей актина между нитями миозина.При этом необходимо наличие Са2+. В покое кальций находится в трубочках саркоплазматического ретикулума. Са-зависимая АТФ-аза как бы закачивает Са2+ в трубочки за счет распада АТФ. Т.е. если много АТФ, то свободного Са++ мало.
Если возникает раздражение нервного волокна, то Са2+ выходит из саркоплазматического ретикулума за счет изменения проницаемости мембраны, и выход его приводит к взаимодействию головки миозина с актином. Если есть Са2+ и АТФ, то белки продвигаются друг между другом. В покое миозин связан с Mg и АТФ. Если нет расщепления АТФ, то спайки не образуются. Выход Са2+ вызывает распад АТФ и образование спаек.
1. SR-Ca2+®(нервное возбуждение) SR+ Ca2+
2. активация актина: А-Тр+ Ca2+®А+ Тр- Ca2+
3. активация АТФ-азы кальция: Миозин-АТФ +Н2О+Са2+®(АТФ-аза) Миозин~Фосфат + АДФ
4. взаимодействие миозина и актина: М~Ф + А ®(+Са2+, +Н2О)М~А + Фн
5. М~А ®(сокращение)М-А+ работа
Миозиновая регуляция -характерна для гладких мышц. У гладких мышц нет тропониновой системы, а легкая цепь (р-цепь) миозина подавляет его АТФ-азную активность и препятствует присоединению миозина к F-актину.В саркоплазме гладких мышц присутствует киназа легких цепей миозина, зависимая от Са2+. При повышении в саркоплазме Са2+, он присоединяется к кальмодулину. Комплекс кальмодулин-4Са2+ активирует киназу легких цепей миозина.Активнаякиназа легких цепей миозина фосфорилирует легкую цепь р, которая при этом перестает ингибировать АТФ-азную активность миозина и препятствовать взаимодействию миозина с F-актином. В результате начинается сократительный цикл. Актиновая регуляция- характерна для поперечнополосатых мышц - скелетных и сердечной.Мышечное сокращение скелетных мышц ингибирует тропомиозиновая система на 2 стадии сокращения, так как TпIпредотвращает присоединение миозиновой головки к соответствующему связывающему сайту F-актина (TпIили изменяет конформацию F-актина или перемещает тропомиозин в то положение, в котором он блокирует сайты связывания миозиновых головок на F-актине). Поступающий в саркоплазму Са2+ присоединяется к тропонинуТnС. Комплекс ТnС•Са2+реагирует с TnIиТnТ, влияя на их взаимодействие с тропомиозином.Тропомиозин при этом либо отсоединяется, либо изменяет конформацию F-актина таким образом, что появляется возможность присоединения к нему миозиновой головки тяжелой цепи. Начинается сократительный цикл.
БИЛЕТ 29)Биосинтез ВЖК происходит во время еды.Субстраты:ацетил-КоА.
цикл включает 6 этапов. Ацетил-КоА используется только на 1 этапе, как “затравка синтеза” с образованием 3-х углеродного соединения малонил-КоА.
Этапы: 1)транспорт ацетил-КоА из митохондрий в цитозоль с помощью цитратного челночного механизма:цитрат+АТФ+КоА-SHàацетил-S-КоА+АДФ+Фн+ОАА; 2)синтез малонил-КоА в реакции карбоксилирования ацетил-S-КоА: СН3-СОSKoA (это ацетил-КоА)® (АцКоА-карбоксилаза (биотин), +СО2, +Н2О, АТФ®АДФ+Фн) СOOН-СН2-СОSKoA (это малонил-КоА); 3)Сборка цепи: катализирует синтазный комплекс(ацетилТР,малонилТр,кетоацилсинтаза,кетоацилредуктаза,гидратаза,редуктаза,тиоэстераза,АПБ): СOOН-СН2-СОSKoA (это малонил-КоА) ® (малонилтрансфераза, +HS-АПБ, -HS-KoA) СOOН-СН2-СОSАПБ (это малонил-АПБ); СН3-СОSKoA (это Ац-КоА)®(ацилтрансфераза, +HS-АПБ, -HS-KoA) СН3-СОSАПБ (это ацетил-АПБ).4) конденсация малонила и ацетила под влиянием синтетазы (конденсирующий фермент): СOOН-СН2-СОSАПБ (это малонил-АПБ) + СН3-СОSАПБ (это ацетил-АПБ)®(конденсирующий фермент, -СО2, -HS-АПБ) СН3-С(О)-СН2-СОSАПБ (это ацетоацетил-АПБ).; 5) восстановление b-кетоацетила-АПБ при участии редуктазы (НАДФН2):СН3-С(О)-СН2-СОSАПБ (это ацетоацетил-АПБ)® (редуктаза, НАДФН2®НАДФ) СН3-СН(ОН)-СН2-СОSАПБ (это b-гидроксибутирил-АПБ).; 6) дегидратация b-гидроксибутирила-АПБ:СН3-СН(ОН)-СН2-СОSАПБ (это b-гидроксибутирил-АПБ)®(дегидратаза, -Н2О) СН3-СН=СН-СОSАПБ (это кротонил-АПБ или еноилацетил-АПБ).7) восстановление еноилацетила-АПБ при участии редуктазы (НАДФН2):СН3-СН=СН-СОSАПБ (это кротонил-АПБ)®(редуктаза, НАДФН2®НАДФ) СН3-СН2-СН2-СОSАПБ (это бутирил-АПБ).
Т.о., в результате первого цикла синтеза ВЖК образуется 4-х углеродный фрагмент. Далее, в зависимости от того какую ВЖК в клетке нужно синтезировать, будут последовательно и циклично присоединяться молекулы малонил-КоА. Завершается синтез любой ВЖК реакцией гидролиза с участием фермента деацилазы: R-СН2-СН2-COSАПБ ®(деацилаза, +Н2О, -HS-АПБ) R-СН2-СН2-COОН (это ВЖК).
Регуляция процесса: главный регуляторный фермент-ацетил-КоА карбоксилаза(превращение ацетил-КоА в малонил-КоА).Метаболическая рег-ия:1)ассоциация-диссоциация:в неактивной форме фермент-это отдельные комплексы из 4-х субъединиц.Активаторы:цитрат;Ингибиторы:пальмитоил-КоА,вызывает диссоциацию;2)фосфорилирование-девосфорилирование: ф. активен в девосф. состоянии; Гормональная рег-ия:вабсортивный период инсулин активирует фосфотазу,котораядевосфорилирует фермент и начинается синтез.При длительном употреблении пищи богатой углеводами и бедной жирами à увеличение секреции инсулинаàстимулирует синтез ацетил-КоА карбоксилазы àизбыток углеводов превращается в жиры.
БИЛЕТ 30) Выделяют следующие желтухи:
1. Механическая (обтурационная), которая связана с нарушением оттока желчи в клетках по причинам болезни печени, желчного пузыря, при закупорки желчевыводящих путей в случае глистной инвазии, при сдавлении опухолью из вне. В процессе застоя желчи растягиваются желчные капилляры, увеличивается их проницаемость. КБ поступает в кровь, развивается гипербилирубиннемия, за счет КБ.
В крови резко увеличивается активность ферментов: щелочной фосфатазы, гамма-глутамилтрансминазы (ГГТ).
В моче резко увеличивается содержание билирубина, уменьшается уробилина. Количество стеркобилина в кале резко уменьшается, кал становиться ахоличным, т.е. обесцвечивается.
2. Паренхиматозная (острые гепатиты). Повреждение гепатоцитов при острых гепатитах (инфекционные заболевания, вирус гепатита, отравление), при этом уменьшается активность глюкоуронил-ТФ, что ведет к нарушению образования КБ. Токсическое воздействие на биомембрану ведет к увеличению проницаемости мембран гепатоцитов и переводу в кровь НБ и КБ. Развивается смешенная гипербилирубинемия.
В крови резко увеличивается активность ферментов: ЛДГ, АлАТ, АсАТ.
В моче, в больших количествах обнаруживается КБ – гипербилирунурия, уробилин, содержание стеркобилина в кале уменьшается.
3. Гемолитическая. Гемолиз эритроцитов может быть при гемолитических болезнях новорожденных, при переливании несовместимой группы крови, при дефиците ферментативных систем эритроцита, при гемоглобинозах (нарушение структуры гема, гемоглобина).
В крови наблюдается гипербилирубиннемия за счет НБ. Резко уменьшается количество эритроцитов и содержание гемоглобина.
В моче билирубин отсутствует, резко увеличивается содержание уробилина, содержание стеркобилина в кале увеличивается.
Моча таких больных интенсивно оранжевая, кал темный.
4. Физиологическая желтуха новорожденных. Обычно развивается на 3-4 сутки после рождения и держится в среднем 7-8 дней. Встречается у 80% новорожденных и связана с тем, что при рождении в крови содержится много эритроцитов, скорость распада которых высокая, а детоксикация билирубина в печени в первые дни после рождения развита слабо по причине низкой активности генов, ответственных за синтез глюкуронил-ТФ.
У недоношенных детей желтуха выражена сильнее и держится 4-5 недель. Если содержание билирубина в крови высокое и держится долго, то страдает, прежде всего, ЦНС. В этом случае необходимо проводить переливание крови, вводить барбитураты, которые индуцируют метаболизм билирубина в печени, т.е. конъюгацию с глюкуроновой кислотой. Проводимаясветотерапия ускоряет выведение билирубина из организма.
Пигментный обмен: Печени принадлежит роль в распаде окрашенных сложных белков - хромопротеидов. При этом образуются желчные пигменты. Определение этих пигментов в крови и моче используется для диагностики заболеваний печени. Основным источником образования желчных пигментов является гемоглобин. Билирубин - продукт метаболизма гемоглобина. За сутки у человека распадается примерно 1% циркулирующих эритроцитов и образуется 80-95% билирубина.
Распад гема:Большая часть гемхромагенных пигментов в организме человека образуется при распаде гема. Главным источником гема является гемоглобин. Катаболизм гема, освобождение от белковой части происходит в микросомальной фракции при участии сложной гем-оксигеназной ферментативной системы, требующей наличие НАДФН2 и кислорода. При поступлении гема в гемаксиназную систему микросом ионы железа окисляются в ферри форму, т.е. гем превращается в гемин.
гем (Fe2+)® (над: оксигеназа) гемин(Fe3+) (это ферри форма) ® (над: редуктаза; под: НАДФH2®НАДФ) гемин (Fe2+) (ферро форма) ® (над: редуктаза, +О2; под: НАДФН2®НАДФ)оксигемин (Fe3+)® (над: редуктаза, +О2; под: -СО, -Fe3+)биливердин® (над: НАДФН2®НАДФ) ®билирубин® (над: +альбумин) билирубин-альбумин (неконъюгированный билирубин - НБ).
Образованный в клетках билирубин является токсическим веществом, удаляется из них и поступает в кровь, взаимодействуя с транспортными белками - альбуминами. Образованное комплексное соединение билирубин-альбумин называется неконъюгированный билирубин - НБ.
НБ имеет свойства:
1. токсичен;
2. гидрофобен;
3. адсорбирован на альбумине;
4. не проходит через почечный эпителий;
5. не дает прямой реакции с диазо-реактивом Эрлиха.
НБ с помощью альбумина поступает для детоксикации в печень, где в гепатоцитах, в реакции конъюгации с глюкуроновой кислотой, при участии ТФ образуются:
- билирубин-моноглюкурониды (20%);
- билирубин-диглюкурониды (80%).
Эти билирубины носят название конъюгированного билирубина – КБ.
КБ имеет свойства:
1. не токсичен;
2. гидрофилен;
3. не связан с белками;
4. легко проникает через почечный барьер;
5. дает прямую реакцию с диазо-реактивом Эрлиха.
Этот билирубин (КБ) может проникать в кровяные капилляры. В плазме крови на его долю приходиться 25%, от общего билирубина, который в норме составляет 8-20 мкмоль/л.
Далее из печени КБ в составе желчи поступает в клетки, где под влиянием ферментов микрофлоры он гидролизуется. Отщепившаяся глюкуроновая кислота всасывается в слизистую кишечника и через воротную вену вновь поступает в печень, где может использоваться для детоксикации.
Билирубин под влиянием ферментов кишечной микрофлоры многократно восстанавливается, превращается в мезобилиноген, часть которого может всасываться слизистой и через систему воротной вены поступать в печень, где разрушается до моно-, дипирролов, которые из организма удаляются в составе желчи с каловыми массами.
Незначительная часть мезобилиногена с током крови поступает в почки, где превращается в другой пигмент – уробилиноген, который, окисляясь, образует пигмент мочи – уробилин.
В моче здорового взрослого человека массой 70 кг уробилин присутствует в следовых количествах.
За сутки (суточный диурез в норме равен 1,2-1,5 л) выделяет 1-4 мг уробилина.
Большая часть мезобилиногена в толстом отделе кишечника под влиянием ферментов кишечной микрофлоры, восстанавливаясь, превращается в стеркобилиноген – основной пигмент кала, который, окисляясь, превращается в стеркобилин. За сутки с калом выводиться примерно 280-300 мг стеркобилина .
БИЛЕТ 31) Физиологические компоненты мочи:1) Мочевина- выделяется с мочой от 12 до 36 г/сут.. 2)Креатинин. У мужчин около 1-2 г/сут. У женщин 0,8-1,8г/сут. Выделение отражает мышечную массу и скорость почечного кровотока. 3)Аминокислоты выделяются с мочой около 1,1г/сут. Рост их содержания наблюдается при наследственных и приобретенных нарушениях обмена АК, заболеваниях паренхимы печени, при тяжелых инфекционных заболеваниях, опухолях, травмах, миопатии, коме, гипертиреозе, при нефротическом синдроме. 4)Молочная, пировиноградная, щавелевая, янтарная, уксусная, пропионовая, валериановая и другие кислоты. Их выделение с мочой не превышает 1г/сут. 5) Мочевая кислота (0,2-1,2г/сут). 6)Гиппуроваякислота выделяются с мочой около 0,7г/сут. Образуется при соединении глицина и бензойной кислоты. 7) Аммонийные соли выделяются с мочой около 1г/сут. 8)Минеральные соли (5-7 г/сут). Моча содержит натрий (3-6г/сут), хлор (3,6-9г/сут), калий (1,5-3,2г/сут), кальций (0,1-0,25г/сут), магний (0,1-0,2г/сут), неорганический фосфор (0,9-1,3г/сут), сульфаты (1,8 г/сут).Выделение NaCl(норма 8-15г/сут) 9)ядовитые вещества С мочой из организма выделяются после их обезвреживания в печени путем конъюгации с серной или глюкуроновойкислотами. Патологические компоненты мочи: Протеинурия (наличие белка в моче > 0,033г/л) наблюдается после тяжелой физической работы, при нефритах, гломерулонефритах, нефротическом синдроме (> 2г/л), амилоидозе (> 2г/л), острых инфекциях, отравлениях и т д. Глюкозурия (наличие глюкозы в моче > 200 мг/сут) появляется в норме при стрессе, у беременных, избытке углеводов в пище. Патологическаяглюкозурия - при сахарном диабете, почечном диабете, избытке стероидов, остром панкреатите, наследственном дефекте ферментных систем почечных канальцев, обеспечивающих реабсорбцию глюкозы, отравлении морфином, стрихнином, фосфором, хлороформом. Обычно она составляет 10-20г, бывает до 100г Кетонурия (наличие кетоновых тел в моче > 50мг/сут) появляется при сахарном диабете, голодании, кахексии, гиперинсулинизме, тиреотоксикозах, послеоперационный период, гликогенозах (I,II,IV), акромегалиях, инфекциях, интоксикациях. Гемоглобинурия появляется после переохлаждении, при гемолитических анемиях, гемоглобинопатиях, при сепсисе, ожогах, отравлениях сульфаниламидами, ядами грибов, иодоформом, анилином. Гематурия появляется при остром нефрите, гломерулонефрите, пиелонефрите мочекаменной болезни, циститах, инфаркте почек, ишемии почек, опухоле почек, амилоидозе почек, аденоме простаты, лихорадке. Порфиринурия (в норме порфирины до 300мкг/сут). Порфирины появляется в моче при порфириях, цирозе печени (в 10-12 раз), отравлении свинцом, мышьяком, барбитуратами, лекарствами. Билирубинурия возникает при механической, паренхиматозной желтухе. Лейкоцитурия возникает при пиелонефритах, гломерулонефритах, туберкулезе почек, амилоидозе почек, воспалении мочевыводящих путей (циститах, уретритах) Фруктозурия возникает при фруктоземии. Креатин появляется в моче при употреблении большого количества креатина с пищей, при нарушении его превращения в креатинин при заболеваниях мышц (миопатиях, мышечных дистрофиях), поражении печени, сахарном диабете, гипертиреозе, акромегалии, аддиссоновой болезни, инфекциях, переохлаждении, судорогах.
Проведение биохимического анализа мочи позволяет выявлять патологии работы почек, печени, эндокринных желез, даже костной и мышечной ткани.
рН в норме=5-7.Увеличение кислотности мочи происходит при чрезмерном употреблении растительной или молочной пищи, минеральной воды. Сдвиг рН в большую сторону может быть следствием приема некоторых препаратов: адреналина, бикарбонатов, никотинамида. Повышенная кислотность может свидетельствовать о нарушении секреции желудочного сока, пилорической непроходимости. Кислотность мочи выше нормы может наблюдаться в следующих случаях: При дегидратации. При поносе. При диабетическом кетоацидозе. При ацидозе. При голодании. При инфекциях мочевыводящих путей. При хронической почечной недостаточности.
БИЛЕТ 32) Ф-ииЖК: являются мощными эмульгаторами липидов,учавствуют в образовании мицеллы,активаторылиполитическихферментов,синтез ЖК является главным путем от избытка ХС. Синтез: представители-холевая(ОН-групаа в 12 положении),дезоксихолевая (нет ОН в 12) первичные кислотыбразующиеся из общего предшественника- 7-а-гидроксихолестерола;Первый этап-является 7-а-гидроксилирование.Скорость-лимитирующая р-ия с участием О2,НАДФН+Н,вит С,цитохрома Р-450,ф-7-а-гидроксилаза.
В норме первичные ЖК поступают в составе желчи в виде конъюгантов с глицином и тауриномàгликохолевая,гликохенодезоксихолевая,туарохенодезоксихолевая кислоты.(ЖК рассматри
|
|
|


