 |
Структура и свойства липидов мембран
|
|
|
|
Мембранные липиды - амфифильные (амфипатические) молекулы, т.е. в молекуле есть как гидрофильные группы (полярные "головки"), так и алифатические радикалы (гидрофобные "хвосты"), самопроизвольно формирующие бислой. они составляют около 30-70% массы мембраны В мембранах присутствуют липиды трёх главных типов - фосфолипиды, гликолипиды и холестерол (холестерин).
Липидный состав мембран различен, содержание того или другого липида, по-видимому, определяется разнообразием функций, выполняемых этими липидами в мембранах.
Фосфолипиды. Все фосфолипиды можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды. Глицерофосфолипиды-Наиболее распространённые глицерофосфолипиды мембран - фосфатидилхолины и фосфатидилэтаноламины.На долю глицерофосфолипидов (полярная группа - инозитол) приходится лишь 2-8% всех фосфолипидов.Специфические фосфолипиды внутренней мембраны митохондрий - кардиолипины (дифосфатидилглицеролы)
В плазматических мембранах клеток в значительных количествах содержатся сфингомиелины - главные липиды миелиновой оболочки нервных волокон.
Гликолипиды. В гликолипидах гидрофобная часть представлена церамидом.
Холестерол. Холестерол присутствует во всех мембранах животных клеток. Его молекула состоит из жёсткого гидрофобного ядра и гибкой углеводородной цепи, единственная гидроксильная группа является "полярной головкой
К основным функциям мембран можно отнести:
- отделение клетки от окружающей среды и формирование внутриклеточных компартментов(отсеков);
- контроль и регулирование транспорта огромного разнообразия веществ через мембраны;
- участие в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов;
- преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ.
Трансмембранный перенос малых молекул - Диффузия(пассивная,облегченная),активный транспорт
|
|
|
Типы переноса веществ через мембрану-
Существуют транслоказы, переносящие только одно растворимое в воде вещество с одной стороны мембраны на другую- "пассивный унипорт". Примером унипорта может служить функционирование ГЛЮТ-1 - транслоказы, переносящей глюкозу через мембрану эритроцита
Некоторые транслоказы могут переносить два разных вещества по градиенту концентраций в одном направлении - пассивный симпорт, или в противоположных направлениях - пассивный антипорт
Перенос через мембрану макромолекул и частиц: эндоцитоз и экзоцитоз
Цикл эндоцитоза начинается в определённых участках плазматической мембраны, называемых "окаймлённые ямки". Белок клатрин образует решётчатые структуры, связанные с углублениями на поверхности плазматической мембраны.
Окаймлённые ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлённые пузырьки (пиноцитозные пузырьки). Время жизни окаймлённых ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза.
Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану.Примером рецептор-зависимого эндоцитоза может служить поступление в клетку холестерола в составе липопротеинов низкой плотности (ЛПНП)
В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране длясекреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса.
|
|
|
Для регулируемой секреции характерны хранение приготовленных на экспорт молекул в транспортных пузырьках и их слияние с плазматической мембраной только при воздействии на клетку специфического стимула. С помощью регулируемой секреции происходят выделение пищеварительных ферментов в период переваривания пищи, а также секреция гормонов, нейромедиаторов и других биологически активных веществ.
Экзаменационный билет №46
Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.
Продуктами реакции являются СО2 и биогенные амины.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазамиаминокислот, простетическая группа которых представлена пиридоксальфосфатом, как и у аминотрансфераз. Таким образом, в двух совершенно различных процессах обмена участвует один и тот же кофермент.образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма.

Гистамин образуется при декарбоксилировании гистидина.
Серотонин образуется из триптофана в нейронах гипоталамуса, функционирует как нейромедиатор в ЦНС, оказывает мощное сосудосуживающее действие, регулирует АД
ГАМК образуется при декарбоксилированииглутаминовой кислоты, оказывает тормозящее действие на ЦНС (нейрогуморальный ингибитор).
Дофамин образуется из тирозина в почках, надпочечниках, синаптических ганглиях и нервах, является нейромедиатором ингибирующего типа.
Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- производные а.к тирозина(гидроксифенилаланин.Тироцитывырабатываеют 2 горнома – Т3 и Т4
Структура
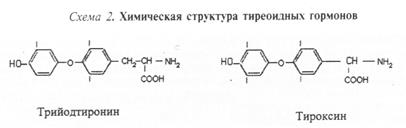
Синтез включает в себя 4 этапа
Вступление йода в ЩЖ, йодирование или органификация йода(окисление йода и йодирование и образование йодтиронинов), конденсация, протеолиз и секреция тиреоидных гормонов
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточныйколлоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов
Транспорт йода в клетки щитовидной железы. Йод поступает в ЖКТ с пищей и питьевой водой. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в клетки щитовидной железы - энергозависимый процесс и происходит при участии специального транспортного белка против электрохимического градиента. Работа этого йодид-переносящего белка сопряжена с Nа+,К+-АТФ-азой. Окисление йода. Окисление I- в I+ происходит при участии гемсодержащейтиреопероксидазы и Н2О2 в качестве окислителя.
Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.
Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойодтирозинов (МИТ) и дийодтирозинов (ДИТ). Две молекулы ДИТ конденсируются с образованием йодтиронина Т4, а МИТ и ДИТ - с образованием йодтиронина Т3. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку путём эндоцитоза и гидролизуется ферментами лизосом с освобождением Т3 и Т4. В нормальных условиях щитовидная железа секретирует 80-100 мкг Т4 и 5 мкг Т3 в сутки. Ещё22-25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях по 5'-углеродному атому.
|
|
|
|
|
|
Экзаменационный билет №47
Синтез холестерина. Регуляция синтеза. Синтезируют все клетки, кроме эритроцитов.Значительное количество- в печени, слизистой тонкой кишки,коже.
1 стадия Биосинтез мевалоновой кислоты
в цитоплазме, в аэробных усл,после приема пищи с углеводами.Основной субстрат – ацетил-КоА из углеводов и из а.к.Ацетил-КоА при помощи челночного механизма в цитоплазму.Необходимы НАДФН+ +Н+, его источние ПФП,окислительное декарбоксилированиемалата в пируват,изоцитрата в а-кетоглутарат.
-реакция конденсации 2 молекул Ацетил-КоА, с образованием ацетоацетил-КоА. Фермент – тиолаза– конденсация ацетоацетил-КоА с Ацетил-КоА, с участием,воды, фермент – ГМГ-КоА-синтетаза, образуется ГМГ-КоА.
- восстановление ГМГ-КоА в мевалоновую кислоту. НАДФН+ +Р+, фермент – ГМГ-КоА-редуктаза
2 стадия образование сквалена – 3АТФ
3 стадия- циклизация сквалена под действием циклазы в ланостерин->20 реакций->ХС
Регуляция метаболическая и гормональная
метаболическая – суточные колебания – максимум в полночь,минимум утром
в энтероцитах хенодезоксихолевая кислота подавляет синдез эндогенного ХС(denovo)
гормональная регуляция – инсулин,Т3 И Т4 – повышают активность ферментов,глюкагон и глюкокортикоиды – снижают.Осуществляет по мех-му ковалентной модификации – фосфолирование/дефософолирование
Значение – ХС в печени окисляется в желчные кислоты,синтез стероидных горнов,избыток ХС удаляется в виде вторичных желчных кислот, ХС удаляется со слущенным эпителием в кишечнике, коже и сальных железах.
Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
химической природе альдостерон – это стероидный гормон, вырабатываемый корой надпочечников позвоночных. Т.е. альдостерон является кортикостероидом.
Мех-м действия – внутриклеточный
органы мишени –почки,слюнныежелезы,ЖКТ, миокард
Биологические эффекты – регулирует обмен Na. Усиливает обратное всасывание ионов натрия в органах-мишенях.Потенцирует эффекты катехоаминов и оказывает на сердце положительное инотропное действие.Высокие концентрации альдостерона в плазме крови вызывают снижение секреции ренина в почках за счет угнетения баро- и натриевых рецеторов.
Ингибирет синтез и секреция альдостерона –ДОФА
Экзаменационный билет №48
Кальцитонин: химическая природа, механизм действия и биологические эффекты.
Выработка в К-клетках ЩЖ, в вилочковой и паращитовидных железах.Хим.природа – пептидная.Мех-м действия: мембранно-внутриклеточный.Органы-мишени –кости,почки,желудок,кишечник,ЦНС
Биологические эффекты – 1)подавляет резобцию костного минерала остеокластами – ингибитор активности остеокластов 2)подавляет реабсорбциюСа и фосфатов, а также Na,K,Mgв почках 3)снижает секрецию гастрина и HClв желудке, трипсина и амилазы в экзокринной части поджелудочной железы 4)Усиливает поступление в кишечник воды и Na,K и Сl. 5)Оказывает прямой анальгетический эффект, действуя на рецепторы клеток гипоталамуса и лимбической системы.
Паратиреоидный гормон: химическая природа, органы-мишени, биологические эффекты
Хим.природа – полипептид, мех-м действия – мембранно-внутриклеточный, органы- мишени – кости скелета, почки,кишечник. Биологические эффекты – сохранение содержания Са в организме и увеличение их концентрации в жидкостях организма. В почках – усиление реаборбцииСа почками, усиление образования из предшест. гормональной формы витамина Д, действуя на кишечник она увеличивает процесс всасывания и поступления Са в организме.Рецеторы в ПТГ располагаются на поверхности остеобластов->они в р-те стимуляции выделяют факторы(цитрат, лактат,лизосомальные ферменты) стимулирующие активность дрг. Клеток костей, обладающие способностью разрушать костный материал – остеокластов. Резорбция остеокластами кости сопросвождается поступлением в кровь Са и фосфатов. Однако содердание фосфатов под действием ПТГ уменьшается из-за снижения реабсорбции фосфатов в почках.
|
|
|
Влияние на обмен кальция и фосфора гипо- и гиперпродукции ПТГ. Гипофункция Возникает при случайном удалении железы при операциях на щитовидной железе, аутоиммунной деструкции ткани желез. Возникающая гипокальциемия и гиперфосфатемия проявляется в виде высокой нервно-мышечной возбудимости, судорог, тетании. При резком снижении кальция возникает дыхательный паралич, ларингоспазм. ГиперфункцияПервичный гиперпаратиреоз возникает при аденоме желез. Нарастающая гиперкальциемия вызывает повреждение почек, мочекаменную болезнь. Вторичный гиперпаратиреоз является результатом почечной недостаточности, при которой происходит нарушение образования кальцитриола, снижение концентрации кальция и компенсаторное возрастание синтеза паратиреоидного гормона
Экзаменационный билет №49
Активные формы кислорода (АФК). Биологическое действие АФК. К активным формам кислорода (АФК) относятся супероксид (O2), синглетный кислород, Н2О2 и радикал гидроксила (ОН').В организме в результате окислительно-восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) при одноэлектронном восстановлении кислорода (молекула имеет неспаренный электрон на молекулярной или внешней атомной орбите).Источники АФК:1. цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород);2. реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450;3. реакции окисления в лейкоцитах, макрофагах и пероксисомах;4. радиолиз воды;5. под воздействием ксенобиотиков, пестицидов;6. реакции самопроизвольного (неферментативного) окисления ряда веществ.
Супероксид-анион – является одним из наиболее широко распространенных в организме свободных радикалов.Он образуется в клетках болезнетворных бактерий и является повреждающим фактором для мембран клеток паренхиматозных органов человеческого организма. Для лейкоцитов и макрофагов является фактором бактерицидности.Кислородные радикалы обладают высокой реакционной способностью и легко вступают в химические реакции с органическими молекулами для приобретения недостающего электрона.
Кислородные радикалы оказывают воздействие на различные структурные компоненты клеток: ДНК (повреждение азотистых оснований); белки (окисление аминокислотных остатков, образование ковалентных «сшивок»); липиды; мембранные структуры.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, и инициируют тем самым цепные окислительные реакции. Если в реакцию с АФК вступают ненасыщенные жирные кислоты плазматических мембран, говорят о перекисном окислении липидов.
Защита клетки от АФК осуществляется несколькими антиоксидантными ферментами.
Ферментативные компоненты антиоксидантной системы:1) каталаза катализирует реакцию разрушения перекиси водорода. При этом образуются вода и молекулярный кислород: 2Н2О2 ——> H2O + O2. Большое количество каталазы содержится в эритроцитах для защиты гема гемоглобина от окисления;
2) супероксиддисмутаза (СОД) катализирует реакцию обезвреживания двух молекул супероксиданиона, превращая одну из них в молекулярный кислород, а другую — в перекись водорода (менее сильный окислитель, чем супероксиданион): О2. + О2.+ 2Н^+ —> H2O2 + O2. Работает в паре с каталазой и содержится во всех тканях;3) пероксидаза восстанавливает перекись водорода до воды, но при этом обязательно идет окисление другого вещества — восстановителя. В организме человека это глутатион — трипептид: g-глутамил-цистеил-глицин. SH-группа цистеина, входящего в состав глутатиона, может отдавать всего 1 атом водорода, а для пероксидазной реакции необходимы 2 атома. Поэтому молекулы глутатиона работают парами. Реакция: 2Н2О2 + 2Г-SH ——> H2O + Г-S-S-Г, где Г-SH — глутатион, -S-S- дисульфидный мостик.Глутатион постоянно поддерживается в восстановленном состоянии в эритроцитах для защиты гема гемоглобина от окисления.
Неферментативные компоненты антиоксидантной системы:1) витамины Е (токоферол) и А (ретинол) в составе клеточных мембран; 2) церулоплазмин — белок плазмы крови, принимающий участие в транспорте меди; 3) мочевая кислота. Компоненты принимают неспаренные электроны от активных форм кислорода, при этом образуется радикал антиоксиданта, который малоактивен. Реоксигенационный синдром. В основе реперфузионно-реоксигенационного синдрома (РРС) нижних конечностей лежит развитие во включенной в кровоток ишемизированной конечности сложного комплекса патофизиологических изменений, в т.ч образование АФК.Развившийся РРС пролонгирует период ишемии тканей конечности, и прежде всего скелетных мышц, способствуя нарастанию в них дистрофических процессов.Следовательно, выраженность РРС может быть снижена проведением ряда патогенетически обоснованных мероприятий, направленных на лечение и профилактику как феномена no-reflow, так и феномена reflow-paradox. К таким мероприятиям относятся: 1) ослабление активности нейтрофилов; 2) нормализация функционального состояния эндотелиальных клеток; 3) устранение пролонгированной вазоконстрикции; 4) нормализация микрососудистой проницаемости; 4) восстановление прооксидантно-антиоксидантного равновесия.Кальциевый парадокс. Кальциевый парадокс — это перегрузка кардиомиоцитов ионами кальция. Известно, что тотальная 1-часовая ишемия изолированного сердца и его последующая реперфузия вызывают 10-кратное увеличение уровня кальция в кардиомиоцитах. Ионы кальция в избытке проникают через сарколемму кардиомиоцитов, накапливаясь в саркоплазматическом ретикулуме и митохондриях. Механизм усиленного проникновения Са2+ через клеточную мембрану тесно связан с реоксигенационным нарушением Na+/Ca2+ обмена. Если в норме основное поступление Са2+ в клетку происходит через медленные Са2+ -каналы, то в условиях реперфузии резко активируется Nа+/Са2+-транспорт (обмен внутриклеточного Na+ на внеклеточный Са2+), который осуществляется белком-переносчиком, расположенным на сарколемме. Полагают, что в основе реоксигенационной стимуляции Na+/Ca2+ обмена лежит первоначальная перегрузка кардиомиоцитов ионами натрия, возникающая в периоде ишемии. Кальциевая перегрузка кардиомиоцитов ведет к замедлению процесса расслабления сердца (реперфузионная контрактура), что неизбежно сопровождается уменьшением диастолического объема сердца и снижением сердечного выброса. Патогенез подобной сократительной дисфункции связан не только с замедлением релаксации кардиомиоцитов, но и с энергодефицитом, который вызван тем, что большая часть энергии, образующейся в митохондриях, расходуется на аккумуляцию Са2+ во внутриклеточных органеллах.
Экзаменационный билет №50
Катаболизм ТАГ в клетке. Осуществляется под действием ТАГ-липазы,конечными продуктами ферментативного гидролиза являются – жирные кислоты и глицерол.Жирные кислоты поступают в плазму крови,связываются с альбумином и доставляются в переф.ткани,где они окисляются или идут вновь на синтез липидов.Глицерол поступает из жировой ткани в кровь и утилизируется тканяит, в которых активна глицеролкиназа(печень,почки,кишечник,лактирующая молочная железа).Там глицеролфосфолируется под действием глицеролкиназыобразыется а-глицерофосфот,который окисляется с ДГАФ под действием НАД-зависимой глицеров-3-фософаТ-ДГ.Далее ДГАФ изомерируется под действием триозофосфатизомеразы в 3-ФГА(промежуточный продукт гликолиза и глюконеогенеза)=> из него может образовываться ПВК и глю., а из-за обратимости реакции может образовываться из глюкозы ДГАФ. Катаболизм. ФЛ в клетке. Под действием фосфолипаз А1,А2,С,D, локализованных в мембранах или лизосомах.Образуются: пвк,глицерол,Н3РО4,аминоспирт. Голодание неполное(недоедание) и полное.Главное патологическое проявление – белковая недостаточность. 1ая фаза полного голодания – следует за постабсорбтивным периодом и продолжается сутки. Исчерпываются запасы гликогена, концентрация инсулина снижается в 10-15 раз, концентрация глюкагона и кортизола увеличинается.Нарастает скорость мобилизации жиров и скорость глюконеогенеща из а.к и кглицерина.Концентрация глюкозы снижается до нижних пределов и пожддерживается до следующей фазы. 2ая фаза- около 1ой недели. Мобилизация жиров продолжается, концентрация ЖК в крови увеличивается вдвое, увеличивается образование кетоновых тел в печени и их концентрация в крови. Ацетон не используется в организме и выаодится с выдыхаемм воздухом и через кожу(ощущается на 2-4 день запах).Энергетические потребности мышцу и других органов удовлетворяется за счет ЖК и кетоновых тел.Глю на счет низкой концентрации инсулина не проникает в мышечные ткани.В мозге часть энергетических потребностей обеспечивается кетоновыми телами.Глюконеогенез продолжается за счет распада тканевых белков.Интенсивность обмена в-в снижена. 3-я фаза продолжается несколько недель.Скорость распада белков стабилизируется.Азотистый баланс отрицательный, поскольку поступление азота нет.Снижена скорость распада белков и скорость глюконеогенеза.Для мозга основным источником энергии становятся кетоновые тела. При продолжении голодания – атрофия тканей, уменьшается масса сердечной мышцы и скелетной,печени. Если израсходовано 1/3 ½ белков- смерть.
Экзаменационный билет №51
Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.
Продуктами реакции являются СО2 и биогенные амины.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, простетическая группа которых представлена пиридоксальфосфатом, как и у аминотрансфераз. Таким образом, в двух совершенно различных процессах обмена участвует один и тот же кофермент.образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма.

Гистамин образуется при декарбоксилировании гистидина.
Серотонин образуется из триптофана в нейронах гипоталамуса, функционирует как нейромедиатор в ЦНС, оказывает мощное сосудосуживающее действие, регулирует АД
ГАМК образуется при декарбоксилированииглутаминовой кислоты, оказывает тормозящее действие на ЦНС (нейрогуморальный ингибитор).
Дофамин образуется из тирозина в почках, надпочечниках, синаптических ганглиях и нервах, является нейромедиатором ингибирующего типа.
Адреналин: химическая природа- производные а.к, механизм действия- мембранно-внутриклеточный,в качестве посредников используется Цамф, может использлватьсяинозитолфосфатный мех-м, органы-мишени- мышцы,жироваяклетчатка,печень, биологические эффекты- на печень и мышцы – усиление распада гликогена, активация гликогенолиза, повышение глю в крови. На жировую клетчатку – усиление процессов липолиза,поступление свободных жирных кислот и глицерина в кровь.Вместе с симпатической нервой системой – повышение минутного объема сердца,ЧСС,АД, сужение сосудов внутренних органов и расширение сосудов скелетной мускулатуру. “Пробуждающее” влияние катехоламинов на ЦНС сокращает латентный период и ускоряет ответные реакции.
Экзаменационный билет №52
Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.
Продуктами реакции являются СО2 и биогенные амины.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, простетическая группа которых представлена пиридоксальфосфатом, как и у аминотрансфераз. Таким образом, в двух совершенно различных процессах обмена участвует один и тот же кофермент.образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма.

Гистамин образуется при декарбоксилировании гистидина.
Серотонин образуется из триптофана в нейронах гипоталамуса, функционирует как нейромедиатор в ЦНС, оказывает мощное сосудосуживающее действие, регулирует АД
ГАМК образуется при декарбоксилированииглутаминовой кислоты, оказывает тормозящее действие на ЦНС (нейрогуморальный ингибитор).
Дофамин образуется из тирозина в почках, надпочечниках, синаптических ганглиях и нервах, является нейромедиатором ингибирующего типа.
Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- производные а.к тирозина(гидроксифенилаланин.Тироцитывырабатываеют 2 горнома – Т3 и Т4
Структура
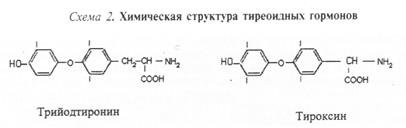
Синтез включает в себя 4 этапа
Вступление йода в ЩЖ, йодирование или органификация йода(окисление йода и йодирование и образование йодтиронинов), конденсация, протеолиз и секреция тиреоидных гормонов
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов
Транспорт йода в клетки щитовидной железы. Йод поступает в ЖКТ с пищей и питьевой водой. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в клетки щитовидной железы - энергозависимый процесс и происходит при участии специального транспортного белка против электрохимического градиента. Работа этого йодид-переносящего белка сопряжена с Nа+,К+-АТФ-азой. Окисление йода. Окисление I- в I+ происходит при участии гемсодержащейтиреопероксидазы и Н2О2 в качестве окислителя.
Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.
Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойодтирозинов (МИТ) и дийодтирозинов (ДИТ). Две молекулы ДИТ конденсируются с образованием йодтиронина Т4, а МИТ и ДИТ - с образованием йодтиронина Т3. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку путём эндоцитоза и гидролизуется ферментами лизосом с освобождением Т3 и Т4. В нормальных условиях щитовидная железа секретирует 80-100 мкг Т4 и 5 мкг Т3 в сутки. Ещё 22-25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях по 5'-углеродному атому.
Гипо- и гипертиреоз – гипотериоз у новорожденных – приводит к развитию кретинизма.Развивается в р-те недостаточности йодтиронинов, обычно это связано с недостаточностью фун-цииЩЖ,может возникать при заболеваниях гипофиза и гипоталамуса.Тяжелая форма- сопровождается отеком кожи и кодкожной клетчатки – микседема из-за накопления гликозаминогликанов и воды.Удете старшего возраста – отставание в росте без задержки умственного развития.У взрослых причина – аутоимунныйтиреоидит(зоб Хашимото),поражение ионизирубщемизлучени. При недостаточности поступления йода формируется – эндемический зоб. В р-те снижается основной обмен,скоростьгликолиза,мобилизации гликогена и жиров,потреблениеглюмышцами,уменьшаетсямыш.масса, снижается теплопродукция.Гипертериоз возникает вледствии повышенной продукции йодтиронинов. Диффузный токсический зоб – Базедова болезнь,болезньГрейвса или при токсической аденоме ЩЖ.Стимулируется рост и дифференцировка тканей,распадуглеводов,липидов и белков.Имеет место отрицательный азотистый баланс.
Экзаменационный билет №53
Обмен железа: основные функции,- 1)Гемоглобин –транспорт кислорода и углекислого газа2)Миоглобин –депонирование кислорода в тканях 3)каталаза- дисмутация перекиси водорода,антиоксидантная защита 4)цитохромы,негемовое железо – компоненты ЦПЭ митохондрий и микросом 5)Рибонуклеотидредуктаза, ксантиноксидаза, сукцинат-ДГ6)Трансферрин – белок острой фазы,комитоген пролиферации Т-лимфоцитов 7)Неферментативная генерация активных форм кислорода. пул железа в организме- на клеточный и внеклеточный.Клеточное железо ассоциировано с металлопротеидами в макрофагах, а также с порфиринами в эритроцитах и миоцитах, в митохондриальных ферментах (сукцинатдегидрогеназа, ксантиноксидаза), в ферментах, использующих железо в качестве кофермента (аконитаза, рибонуклеотидредуктаза).Внеклеточное железо содержится в основном в сыворотке крови и связано с белками - трансферрином, лактоферрином, гемопексином, ферритином - или находится в виде свободных ионов. в лимфе и других биологических жидкостях. Всасывание железа в кишечнике, «ферритиновый» блок.
Происходит в желудке под действием HCLпроисходит диссоциация комплексов и образрование ферро- и ферри-ионов.Железо поглощается в 2х видах: Fe2+ и в геме. Восстанавливающие агенты, HClи протеазы переводят железо гема в гемин,который проникает в слиз.желудка, где ксантиноксидаза отделяет железо от порфоринового кольца. В 12перстной и тощей кишках иноныfe+2 всасываются быстрее,чем +3. Для их бустрого восстановления используется аскорбиновая кислота.При всасывании железа на уровне слизистой функционирует “блок слизистой” для всасывания железа.Поступление железа из жнтероцитов в кровь зависит от скорости синтеза в них белков трансферрина и апоферритина. Трансферрин – компонент быстрообменивающей транспортной системы мужду кишкой и кровью.При дефиците Fe–много трансферрина –повышается адсорбция и трапортжелеза.Апофферитин – компонент медленнообменивающей системы в энтероцитах.Апоферритин +Fe = ферритин.ДепонируяFe в энтероците, аппоферетин препятствует его поступлению в кровь – аппоферритиновый блок. Транспорт железа в плазме крови. Транспортируется в комплексе с трансферрином(в-глобулин,транспортный белок, место синтеза – печень,лимфоиднаяткань,молочная железа и половые железы).Каждая молекула трансферрина переносит 2 атома fe+3 вместе с CO3 c образованием комплекса – трансферрин-2 = >взаимодействует с мемб.рецепторамикл и поглощается эндоцитозом.В кислой среде эндосомы железо освобождается от трансверрина. Оставшийся комплекс возвращается наружу, диссоцирует,возвращается в плазму крови. Нарушения метаболизма железа (железодефицитные состояния, гемосидероз). Причины – потеря крови,увеличение потребности в железе при росте, беременности и родах,нарушениевсасываания железа в кишечнике,хроническаяинфекция,алиментарный дефицит железа, прием лекарств. Железодефицитная анемия – уменьшается размер эритроцитов и их пигментация,уменьшается содержание гемоглобина,понижается степень насыщения трансферринажележом,повышается ОЖСС, в тканях и плазме крови снижается концентрация ферритина.Гемохроматоз – повышение содержания железа в организме,повышениеферритинового депо. Образующийся гемосидерин откладывается в виде гранул в печени,подж.железе,селезенке.Ионаы железа токсически воздействуют на ферменты ОВ систем,индуцируют образование активных форм кислорода, перекисное окисление липидов. Причины – наследственное увеличение всасывания железа в кишечнике(первичный),длительная перегрузка организма железом(вторичный).
Экзаменационный билет №54
Биологическая роль печени в регуляции углеводного обмена. Печень поглощает глю,галактозу и фруктозу из воротной вены. В печени идут следующие процессы- гликолез,клюконеогенез,распад и синтез гликогена,ПФ,обмен фруктозы и галактозы,биосинтезгетерополисахаридов. Глюкоза – активность регулирующих ферментов гликолза и гликогенолиза повышается под действием инсулина и тиреоидных гормонов. Глюкоза, синтезируемая в ходе гликогенолиза и глюконеогенеза, поступает в кровь и расходуется всеми клетками организма, а при избытке – депонируется в виде гликогена. Фруктоза – поступающая в печень, может фосфолироваться в положении 6=>фруктозо-6-фосфат гесокиназу. На активность фруктокиназы не влияет ни инсулин,ни голодание. Если отсутсвует фруктозо-1-фосфатальдолаза – развивается наследственная неперносимость к фруктозе. В метаболизме фруктозы в организме участвует фермент сорбитол ДГ(только в печени). Сорбитол->фруктозу.В клетках артериальных стенок,клеткахЩванна, эритроцитах,хрусталика и сетчатки глаза,в семенниках имеется фермент альдозоредуктаза(надфн-зависимый)Он превращает глюкозу в сорбитол.Сорбитол у больных сахорным диабетов накапливается в сетчатке и хрусталике глаза,шванновскиз клетках и эндотелии.В больших количествах токсичен, увеличивает осмотическое давление, клетки набухают, развивается отек. В р-те происходит помутнение хрусталика. Клетки печени также активно превращают сорбитол во фруктозу. Галактоза образуется в кишечнике в р-те гидролиза лактозы и,попав,в печень, включается в мет.путь. Обратимость эпимеразной реакции важна для синтеза галактозильных остатков в гликолипидах и гликопротеинов. Галактоза необходима для синтеза лактозы в молочных железах. В печени активно образуется глюкуроноваякислота.Она участвует в детоксикационной функции печени.Глюкуроновая кислота с ксенобиотиком и с токсическими в-вами образует глюкурониды.
Глюкуроновая кислота входит в состав гиалуроновойкислоты,хондраитинсульфата и гепарина.
(СХЕМЫ ИЗ МЕТОДИЧКИ ПРО ПИТАНИЕ СО СТРАНИЦ 38 И 40!!!!)
Экзаменационный билет №55
Окислительное дезаминирование(прямое,непрямое) аминокислот. Дезаминирование –процесс удаления а-аминогруппы из аминокислот и выделение ее в виде аммиака.Значение состоит в выделении аммиака,к-ый используется для синтеза мочевины,образовании а-кетокислот,используется для различных метаболических процессов и окислении до углекислоты и воды с образованием жнергии. 2 ВИДА – окислительное(пряммое –для глутаминовойкислоты,непрямое – для остальных) и неокислительное- для серина,треонина,цистеина,гистидина. Прямое окислительно. Глутаминовая кислота подвергается окислительному дезаминированию с образованием аммиака и а-кетоглутаровой кислоты

Фермент ГЛУТАМАТ-ДГ имеется в МХ всех клеток организма(кроме мышечных) и катализирует р-ю дезаминированияглутамата. Кофермент- НАД+.а-кетоглутарат вовлекается в реакцию ЦТК из-за промежуточ
|
|
|


