 |
Категория «Титриметрический (объемный) анализ. Метод кислотно-основного титрования»
|
|
|
|
Категория «Титриметрический (объемный) анализ. Метод кислотно-основного титрования»
:: 001:: Титрование проводится в водной среде. На величину скачка титрования раствора сильной кислоты сильным основанием влияют:
а) концентрации реагирующих веществ, температура
б) температура, ионная сила раствора
в) КW воды, разбавление раствора
г) концентрация титранта, ионная сила раствора, температура
:: 002:: Величина рН в точке эквивалентности больше 7 при титровании:
а) сильной кислоты сильным основанием
б) слабой кислоты сильным основанием
в) сильного основания сильной кислотой
г) слабого основания сильной кислотой
:: 003:: На величину скачка на кривой кислотно-основного титрования влияют:
а) константа диссоциации кислоты (основания), природа растворителя, концентрации реагирующих веществ, температура
б) константа диссоциации кислоты (основания), концентрации реагирующих веществ, рН в точке эквивалентности
в) константа диссоциации кислоты (основания), разбавление, концентрация раствора титранта
г) константа диссоциации кислоты (основания), рН в точке эквивалентности, температура
:: 004:: Значение рН в точке нейтральности больше рН в точке эквивалентности при титровании:
а) слабой кислоты сильным основанием
б) сильной кислоты сильным основанием
в) слабого основания сильной кислотой
г) сильного основания сильной кислотой
:: 005:: Объем (мл) 0, 1000 М раствора NaOH, необходимый для достижения точки эквивалентности при титровании 8, 0 мл 0, 1000 М раствора H2SO4, равен ____ мл.
а) 8, 0мл
б) 12, 0мл
в) 16мл
г) 4мл
:: 006:: Ступенчатые константы диссоциации фосфорной кислоты соответственно равны:
Кa1 (H3PO4)= 7, 5 . 10 -3; Кa2(H3PO4) = 6, 2 . 10 -8; Кa3(H3PO4) = 4, 8 . 10 -13.
|
|
|
Количество скачков на теоретической кривой титрования H3PO4 раствором NaOH равно ____.
а) 3
б) 2
в) 1
г) 0
:: 007:: Ступенчатые константы диссоциации щавелевой кислоты (H2C2O4) соответственно равны:
Кa1 (H2C2O4)= 5, 6 . 10 -2; Кa2(H2C2O4) = 5, 4 . 10-5
Количество скачков на теоретической кривой титрования щавелевой кислоты раствором NaOH, равно:
а) 1
б) 2
в) 0
г) 3
:: 008:: Кислотно-основный индикаторы:
а) слабые неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
б) слабые органические кислоты или основания, окраска которых изменяется при изменении рН среды
в) сильные органические кислоты или основания, окраска которых изменяется при изменении рН среды
г) сильные неорганические кислоты или основания, окраска которых изменяется при изменении рН среды
:: 009:: При выборе индикатора для кислотно-основного титрования учитывают:
а) интервал перехода окраски индикатора, рТ индикатора, температуру
б) показатель титрования (рТ), ионную силу раствора, величину скачка титрования
в) интервал изменения окраски индикатора, рТ индикатора, величину скачка титрования, значение рН в точке эквивалентности
г) показатель титрования рТ, значение рН в Т. Э., разбавление раствора в прoцессе титрования
:: 010:: Интервал изменения окраски индикатора DрН зависит от:
а) концентрации индикатора
б) константы диссоциации индикатора
в) значения рН титруемого раствора
г) интенсивности окраски индикатора
:: 011:: Na2СО3 до угольной кислоты следует титровать раствором HCl с индикатором:
а) фенолфталеином, рТ = 9
б) метиловым оранжевым, рТ = 4
в) тимолфталеином, рТ = 10
г) лакмусом, рТ = 7
:: 012:: При титровании раствора HCl раствором NaOН в присутствии NH4Cl в качестве индикатора следует использовать:
а) лакмус, рТ = 7
б) фенолфталеин, рТ = 9
в) тимолфталеин, рТ = 10
г) метиловый красный, рТ =5
|
|
|
:: 013:: Состав раствора в n-ой точке эквивалентности при титровании раствора H3PO4 раствором NaOН с индикатором фенолфталеином (рТ = 9):
а) NaH2PO4
б) NaH2PO4 + Na2HPO4
в) Na2HPO4
г) Na3PO4
:: 014:: При титровании соды до гидрокарбоната (Kа1(H2СO3) = 4, 5 . 10 -7;
Kа2(H2СO3) = 4, 8 . 10 -11) значение рН титруемого раствора в точке эквивалентности в этом случае равно 8, 3. Индикатор, применение которого приводит к наименьшей индикаторной погрешности:
а) ксиленоловый синий (рТ = 8, 8)
б) фенолфталеин (рТ = 9)
в) тимолфталеин (рТ = 9, 9)
г) феноловый красный (рТ = 8, 1)
:: 015:: Фактор эквивалентности ортофосфорной кислоты при титровании ее раствором щелочи с индикатором метиловым красным (рТ = 5) равен:
а) 1/1
б) 1/2
в) 1/3
г) 1/4
Категория «Общие вопросы титрования».
:: 001:: Раствор первичного стандарта – это:
а) стандартный раствор, который готовят первым при выполнении титриметрического определения
б) стандартный раствор, приготовленный по точной навеске вещества, называемого первичным стандартом
в) стандартный раствор, который готовят методом разбавления
г) стандартный раствор, характеристики которого известны
:: 002:: Раствор вторичного стандарта – это:
а) стандартный раствор, который готовят вторым при выполнении титриметрического определения
б) стандартный раствор, характеристики которого известны
в) стандартный раствор, характеристики которого устанавливают по первичному стандарту
г) стандартный раствор, который готовят методом разбавления
:: 003:: Молярная масса эквивалента тетрабората натрия при использовании его в качестве первичного стандарта для определения характеристик рабочего раствора HCl равна
а) 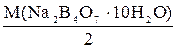
б) 
в) М(Na2В4О7 ∙ 10Н2О)
г) 
:: 004:: В качестве первичного стандарта для определения характеристик рабочего раствора HCl используют:
а) Ва(ОН)2
б) NH4OH
в) NaCl
г) Na2B4O7 . 10H2O
:: 005:: Раствор титранта NaOH готовят:
а) по точной навеске взвешиванием реактива на аналитических весах
б) приблизительной концентрации взвешиванием реактива на технических весах и затем стандартизуют по раствору установочного вещества
в) методом разбавления из его концентрированного раствора и затем стандартизуют по раствору первичного стандарта (установочного вещества)
|
|
|
г) из стандартного раствора, который готовят методом разбавления
:: 006:: Содержание СаСО3 при его определении методом обратного титрования рассчитывают по формуле:
а) n(1/2CaCO3) = n(1/1NaOH)
б) n(1/2CaCO3) = n(1/1HCl)
в) n(1/2CaCO3) = n(1/1NaOH) + n(1/1HCl)
г) n(1/2CaCO3) = n(1/1HCl) – n(1/1NaOH)
:: 007:: Способом прямого титрования можно оттитровать:
а) Na3PO4
б) CaCO3
в) K2SO4
г) CH3COONa
:: 008:: Способом замещения определяют:
а) Nа2СО3
б) NaCl
в) NaHCO3
г) NаОH
д) СаСО3
:: 009:: Формула для расчета содержания NH4+-ионов при определении солей аммония способом отгонки:
а) n(1/1 NH 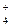 ) = n (1/1 NaOH) – n(1/2 H2SO4)
) = n (1/1 NaOH) – n(1/2 H2SO4)
б) n(1/1 NH 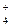 ) = n (1/2 H2SO4)
) = n (1/2 H2SO4)
в) n(1/1 NH 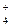 ) = n (1/1 NaOH)
) = n (1/1 NaOH)
г) n(1/1 NH 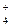 ) = n (1/2 H2SO4) - n (1/1 NaOH)
) = n (1/2 H2SO4) - n (1/1 NaOH)
:: 010:: Содержание солей аммония при определении формальдегидным методом рассчитывают по схеме расчета:
а) n(1/1 NH 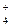 ) = n (NaOH)
) = n (NaOH)
б) n(1/1 NH 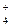 ) = n (HCL) - n (NaOH)
) = n (HCL) - n (NaOH)
в) n(1/1 NH 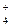 ) = n (HCL)
) = n (HCL)
г) n(1/1 NH 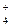 ) = n (NaOH) - n (HCL)
) = n (NaOH) - n (HCL)
:: 011:: Кривой титрования называется:
а) графическое изображение зависимости концентрации определяемого компонента или пропорционального ей свойства системы от значения рН титруемого раствора
б) графическое изображение зависимости концентрации определяемого компонента или пропорционального ей свойства системы от объема прибавленного титранта
в) графическое изображение зависимости концентрации определяемого компонента или пропорционального ей свойства системы от времени
г) графическое изображение зависимости концентрации определяемого компонента или пропорционального ей свойства системы от концентрации прибавленного титранта
:: 012:: Скачок титрования обусловлен:
а) резким изменением концентрации определяемого компонента вблизи точки эквивалентности
б) резким изменением концентрации титранта вблизи точки эквивалентности
в) резким изменением концентрации определяемого компонента вблизи конечной точки титрования
г) резким изменением концентрации титранта вблизи конечной точки титрования
:: 013:: Конечная точка титрования для реакции титрования А + В = С, где А - определяемое вещество, В – титрант:
а) соответствует точке эквивалентности
|
|
|
б) соответствует объему титранта, который отвечает равенству n(fэкв(A)) = n(fэкв(B))
в) отличается от точки эквивалентности на величину индикаторной погрешности и зависит от индивидуальных особенностей восприятия цвета титрующего
г) отличается от точки эквивалентности, но не зависит от выбранного индикатора
:: 014:: Точка эквивалентности на кривой титрования:
а) теоретическая точка, в которой заканчивается титрование
б) практическая точка, по которой определяют результат титрования
в) конечная точка титрования (КТТ)
г) теоретическая точка, соответствующая 100%-ному оттитровыванию определяемого компонента
:: 015:: Скачок титрования на билогарифмической кривой титрования не наблюдается, если:
а) константа равновесия реакции титрования К ≤ 10-3 или концентрация титруемого компонента или титранта < 0, 001М
б) концентрация индикатора < 0, 00001М
в) константа равновесия реакции титрования К ≤ 10-7
г) константа равновесия реакции титрования К ≤ 10-7 или концентрация титруемого компонента или титранта < 0, 001М
:: 016:: Если допустимая погрешность титрования составляет ±0, 1%, то точкой конца скачка титрования считают точку, в которой раствор перетитрован на:
а) 1%
б) 0, 1 %
в) 0, 01 %
г) 0, 001 %
:: 017:: Точка на кривой титрования, соответствующая оттитровыванию определяемого компонента на 100% - точка:
а) эквивалентности
б) промежуточная
в) начальная
г) конечная
:: 018:: Если допустимая погрешность титрования равна 0, 1%, то точка начала скачка на кривой титрования соответствует отитровыванию определяемого компонента на _____%:
а) 99, 9
б) 90, 0
в) 100, 0
г) 100, 1
:: 019:: Визуально определить достижение точки эквивалентности можно:
а) по изменению окраски индикатора
б) по появлению (исчезновению) собственной окраски одного из участников химической реакции титрования
в) инструментально, измеряя подходящим измерительным устройством некоторые характерные свойства вещества
:: 020:: На практике титрование оканчивают:
а) в точке эквивалентности
б) в конечной точке титрования
в) в начале скачка титрования
г) в конце скачка титрования
:: 021:: Выбрать индикатор можно:
а) используя теоретическую кривую титрования
б) используя теоретически рассчитанный объем титранта, израсходованный до точки эквивалентности
в) подобрав нужный индикатор практически
:: 022:: Индикаторы, которые используют в кислотно-основном титровании:
а) фенолфталеин
б) иод-крахмальный
в) ферроин
г) эриохромовый черный Т
:: 023:: Смешанные индикаторы представляют собой смесь:
а) двух индикаторов, каждый из которых можно применять в данном титровании
|
|
|
б) применяемого индикатора с флуоресцентным индикатором
в) используемого индикатора с красителем, играющим роль внутреннего светофильтра
г) из нескольких индикаторов, применяемых в разных методах титрования
:: 024:: Смешанные индикаторы применяют:
а) для уменьшения систематической погрешности
б) для улучшения четкости наблюдаемого изменения окраски
в) для уменьшения индикаторной погрешности
г) только в осадительном титровании
:: 025:: Металлоиндикаторы - органические аналитические реагенты:
а) имеющие различие в окрасках окисленной и восстановленной форм
б) имеющие различие в окрасках кислотной и основной форм
в) имеющие различие в окрасках свободной и связанной в комплекс с металлом форм
г) адсорбирующиеся на осадке и изменяющие при этом свой цвет
:: 026:: Расчеты результатов определений в титриметрии основаны на законе:
а) кратных отношений
б) действующих масс
в) Авогадро
г) эквивалентов
:: 027:: Аликвотная часть – это количество:
а) миллилитров добавленного из бюретки раствора
б) миллилитров отобранного пипеткой раствора
в) миллилитров отобранного мензуркой раствора
г) миллилитров отобранного мерным цилиндром раствора
:: 028:: Мерную посуду используют в титриметрическом анализе для:
а) приготовления растворов вторичных стандартов
б) приготовления растворов первичных стандартов
в) отбора аликвотных частей исследуемого раствора
г) добавления растворов индикаторов
:: 029:: Способ пипетирования при установлении титра стандартного раствора титранта заключается в титровании:
а) серии растворов, приготовленных путем растворения близких точных навесок в колбах для титрования
б) аликвотных частей раствора с приблизительно известной концентрацией
в) аликвотных частей раствора, приготовленного в мерной колбе по точной навеске
г) всего объема раствора первичного стандарта, содержащегося в мерной колбе
:: 030:: Способ отдельных навесок при установлении титра стандартного раствора титранта заключается в титровании:
а) серии растворов, приготовленных путем растворения близких точных навесок в колбах для титрования
б) аликвотных частей раствора с приблизительно известной концентрацией
в) аликвотных частей раствора, приготовленного в мерной колбе по точной навеске
г) всего объема раствора первичного стандарта, содержащегося в мерной колбе
:: 031:: Колбу для титрования перед титрованием необходимо промыть:
а) титрантом
б) титруемым раствором
в) титруемым раствором и высушить
г) дистиллированной водой.
|
|
|


