 |
Категория «Фотометрия». Категория «Хроматография»
|
|
|
|
Категория «Фотометрия»
:: 001:: Оптические методы по характеру взаимодействия электромагнитного излучения с веществом различаются на:
а) атомно – адсорбционный анализ;
б) тетриметрический;
в) весовой;
г) потенциометрический.
:: 002:: Оптические методы по области используемого электромагнитного спектра различают:
а) рефрактометрия;
б) спектроскопия;
в) интерферометрия;
г) поляриметрия.
:: 003: Оптические методы по природе энергетических переходов, различают спектры:
а) протонные спектры;
б) нейтронные спектры;
в) электронные спектры;
г) спектры нуклонов.
:: 004:: Для получения оптимальных результатов при фотометрических измерениях подбирают:
а) рН раствора;
б) цвет раствора;
в) аналитическую длину волны;
г) окислительно – восстановительный потенциал.
:: 005:: Чувствительность фотометрического анализа, определяемая минимальной концентрацией определяемого вещества составляет при L = 1см:
а) 10-3 моль/л;
б) 10-7 моль/л;
в) 10-9 моль/л;
г) 10-5 моль/л.
:: 006:: Погрешность фотометрического метода (Δ min) составляет:
а) 12, 5%;
б) 5%;
в) 36, 8%;
г) 2%.
:: 007:: Фотометрические реакции в экстракционно – фотометрическом анализе:
=а) фотометрические реакции образования окрашенных комплексных соединений металлов;
б) фотометрические реакции образования окрашенных ионных соединений;
в) фотометрические реакции образования цветных осадков;
г) фотометрические реакции образования окрашенных ионных соединений, растворимых в кислотах.
:: 008:: Фотометрическое титрование основан на определении конца титрования:
а) по резкому изменению рК раствора в точке эквивалентности;
|
|
|
б) по резкому изменению светопоглощения титруемого раствора в точке эквивалентности;
в) по резкому изменению окислительно – восстановительного потенциала в точке эквивалентности;
г) по резкому изменению цвета индикатора в точке эквивалентности.
Категория «Хроматография»
:: 001:: Метод ионнообменной хроматографии основан на:
а) на использовании явления ионного обмена между двумя жидкостями;
б) на использовании явления обмена между раствором и газом;
в) на использовании явления ионного обмена между сорбентом и раствором;
г) на использовании явления обмена между газами.
:: 002:: Реакции ионного обмена можно изобразить следующими схемами: (катионный обмен)
а) R – SO 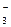 H+ + M+ = R – SO
H+ + M+ = R – SO 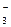 M+ + H+;
M+ + H+;
б) R – SO 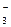 M+ + H+ = R – SO
M+ + H+ = R – SO 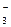 H+ + M+;
H+ + M+;
в) R – SO 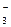 - H+ +A- = R – SO
- H+ +A- = R – SO 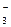 A- + H+;
A- + H+;
г) R – SO 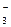 - A- + H+ = R – SO
- A- + H+ = R – SO 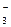 H+ + A-.
H+ + A-.
:: 003:: Реакции ионного обмена можно изобразить следующими схемами: (анионный обмен)
а) R – N(CH3)3 + A- + OH- = R – N(CH3)3OH- + A-;
б) R – N(CH3)3 + OH- + A- = R – N(CH3)3A- + OH-;
в) R –OH- - N(CH3)3 + A- = R – A – N(CH3)3 +OH-;
г) R – A- - N(CH3)3 + OH- = R – OH- - N(CH3)3 + A-/
:: 004:: Наибольшее распространение в ионообменной хроматографии получили:
а) твердые неорганические осадки;
б) органические осадки;
в) синтетические ионообменные смолы;
г) твердые комплексные соединения.
:: 005:: Обменная емкость ионитов (удельная емкость) равна:
а) 0 – 5 ммоль/г;
б) 0 – 1 ммоль/г;
в) 12 – 15 ммоль/г;
г) 2 – 10 ммоль/г.
:: 006:: Наиболее распространенная газовая хроматография (варианты):
а) газоадсорбционная;
б) газожидкостная (распределительная);
в) жидкостная;
г) твердофазная.
:: 007:: Коэффициент распределения в газовой хроматографии определяется:
а) К = С (НФ) / С (ПФ);
б) К = С (ПФ) / С (НФ);
в) К = С (НФ) · С (ПФ);
г) К = С (ПФ) · С (НФ).
:: 008:: Для качественной и количественной обработки результатов анализа разделяемой смеси компонентов используют:
а) электрограммы;
б) потенциограммы;
|
|
|
в) хроматограммы;
г) вольтаграммы.
:: 009:: Коэффициент разделения компонентов α рассчитывается по формуле:
а)  ;
;
б)  ;
;
в)  ;
;
г)  .
.
:: 010:: На разделение компонентов смеси в газовой хроматографии зависят:
а) от давления газов;
б) от времени прохождения компонентов через тарелки;
в) от температуры;
г) от природы определяемых веществ.
:: 011:: Важным параметром в газожидкостной хроматографии является высота, эквивалентная теоретической тарелке – ВЭТТ, определяемая по уравнению Ван-Деелетера:
а) ВЭТТ = Н = А + В/у + Су;
б) ВЭТТ = Н = А – В/у + Су;
в) ВЭТТ = Н = А + В/у – Су;
г) ВЭТТ = Н = А + В(у – Су).
:: 012:: Методы газожидкостной хроматографии используют:
а) для качественного разделения катионов;
б) для разделения различных органических смесей;
в) для качественного разделения анионов;
г) для количественного определения неорганических микрокомпонентов.
|
|
|


