 |
Закон Гесса. Термохимические расчеты
|
|
|
|
МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ
(ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ) МАИ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. ХИМИЧЕСКАЯ КИНЕТИКА.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Учебное пособие к лабораторному практикуму по химии
Под ред. канд. хим. наук
Н.С. Будановой и А.А. Фармаковской
Утверждено
На заседании редсовета
Октября 2007 г.
М О С К В А
Издательство МАИ−ПРИНТ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. ХИМИЧЕСКАЯ КИНЕТИКА.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА:
Учебное пособие к лаб. практикуму по химии
Под ред. Н.С. Будановой и А.А. Фармаковской.
− М.: Изд−во МАИ−ПРИНТ, 2009. − 95 с. ил.
Авторы:
Н. С. Буданова, В. Н. Гразлов, С. И Селиванова, М. А Семенова, В. А Новожилов, А. А. Фармаковская, Н. П. Жарова, Г. Н. Устюжанинова.
Пособие содержит теоретические введения и описания лабораторных работ по двум основным разделам курса химии: «Химическая термодинамика» и «Химическая кинетика», а также по некоторым часто использующимся в аналитической практике физико-химическим методам анализа.
В разделе «Растворы» рассмотрены вопросы, равновесия в растворах неэлектролитов и электролитов, буферные растворы, коллоидные растворы, адсорбционное равновесие, ионообменная хроматография.
Раздел «Электрохимия» посвящен вопросам, связанным с теорией гальванических элементов, электролиза, коррозии, а также практическому применению электрохимических методов анализа.
Пособие предназначено для студентов I курса всех технических факультетов МАИ дневной и вечерней форм обучения.
Рецензенты:
кафедра физики и физической химии Военно-инженерной академии им. Н.Е. Жуковского (зав. кафедрой профессор В. В. Чернышев);
|
|
|
доктор химич. наук, профессор Н. Н. Желиговская (МГУ).
РАЗДЕЛ I. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ГЛАВА 1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Химическая термодинамика изучает переходы энергии из одной формы в другую при химических реакциях и устанавливает направления и пределы их самопроизвольного протекания при заданных условиях.
Объектом изучения в термодинамике является система. Под системой понимают вещество или группу взаимодействующих веществ, физически или мысленно обособленных от окружающей среды. К изолированным относятся те системы, которые не обмениваются массой и энергией с внешней средой. Если через границу, отделяющую систему от внешней среды, может осуществляться обмен веществом между системой и внешней средой, система называется открытой; если обмен веществом невозможен – система закрытая.
Системы бывают гомогенными (однофазными), обладающими одинаковыми физическими и химическими свойствами в любой части объема, и гетерогенными, характеризующимися наличием поверхностей раздела, отделяющих части системы (фазы), различные по свойствам.
Состояние системы описывается термодинамическими параметрами – температурой, давлением, объемом, концентрацией. Изменение термодинамических параметров состояния системы приводит к возникновению термодинамического процесса.
Термодинамические функции, значения которых зависят от состояния системы, называются функциями состояния, и их изменения в каком-нибудь процессе зависят только от начального и конечного состояния системы и не зависят от пути перехода системы из одного состояния в другое. К важнейшим функциям состояния, характеризующим химические системы, относятся внутренняя энергия U, энтальпия H, энтропия S и энергия Гиббса G (изобарно-изотермический потенциал).
|
|
|
Первый закон термодинамики
Первый закон термодинамики может быть сформулирован следующим образом: «Каждая система обладает некоторым запасом внутренней энергии U, мерой изменений которой при обратимых процессах служит теплота q, поглощаемая системой, и работа А, совершаемая системой».
∆U = Q-A. (1.1)
Механическая работа, совершаемая системой против внешнего давления, равна произведению этого давления на изменение объема:
A = p∙∆V. Если объем в процессе перехода системы из состояния 1 в состояние 2 не меняется (V = const – изохорный процесс), то система не совершает работы, а изменение внутренней энергии равно тепловой энергии, выделяемой или поглощаемой системой:
∆U = Qv. (1.2)
Для изобарного процесса (р = const) изменение внутренней энергии при переходе системы из состояния 1 в состояние 2
∆U= Qр- p∙∆V,
откуда
Qр =∆U+p∆V.
Если р = const, то Qр = ∆(U+p∙V), где H = U+p∙V энтальпия, являющаяся функцией состояния, тогда
QP = ∆H (1. 3)
и тепловой эффект изобарного процесса определяется изменением энтальпии системы. Физический смысл энтальпии состоит в том, что она характеризует тепловой эффект реакций, протекающих в изобарных условиях. Из уравнений (1.2) и (1.3) можно записать
QP - Qv = ∆U+p∙∆V-∆U = p∙∆V.(1.4)
Из уравнения Менделеева−Клайперона p∙∆V = ∆n∙R∙T, откуда
QP - Qv = ∆n∙R∙T, (1.5)
где ∆n − изменение числа молей в процессе реакции.
Тепловые эффекты реакций Qv и QP измеряются экспериментально или вычисляются. Увеличение ∆U и ∆Н соответствует эндотермическому процессу (тепло поглощается), а их уменьшение − экзотермическому процессу (тепло выделяется).
Закон Гесса. Термохимические расчеты
Тепловые эффекты химических реакций и фазовых превращений изучает термохимия. Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. В таком уравнении символы реагентов сопровождаются указанием их агрегатного состояния.
Основной закон термохимии сформулирован русским ученым
Г.И. Гессом: «Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а зависит только от природы исходных и конечных веществ и их состояний».
|
|
|
Если система переходит из состояния 1 в состояние 2, то для
p = const и v = const можно записать:
QP = ∆Н1,2 = Н2 – Н1 = 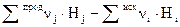 ; (1.6)
; (1.6)
Qv = ∆U1,2 = U2 – U1 =  , (1.7)
, (1.7)
где 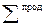 − сумма соответствующих величин для продуктов реакции;
− сумма соответствующих величин для продуктов реакции; 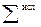 − сумма соответствующих величин для исходных веществ; νi и νj – стехиометрические коэффициенты соответственно перед исходными веществами и продуктами реакции в уравнении.
− сумма соответствующих величин для исходных веществ; νi и νj – стехиометрические коэффициенты соответственно перед исходными веществами и продуктами реакции в уравнении.
Значения тепловых эффектов и величины термодинамических функций обычно относят к стандартному состоянию веществ. В качестве стандартного состояния индивидуальных жидких и твердых веществ принимают наиболее устойчивое состояние их при давлении 1 атм., данной температуре и концентрации 1 моль/л, а для индивидуальных газов – такое их состояние, когда при данной температуре и собственном давлении I атм. они обладают свойствами идеальных газов.
При расчете тепловых эффектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов – теплота образования и теплота сгорания. Их называют также энтальпией образования и энтальпией сгорания, понимая под этим изменение энтальпии в указанных реакциях.
Теплотой образования называется тепловой эффект реакции образования одного моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию рассматриваемого элемента при данной температуре. Теплоту образования одного моля соединения при давлении 1013 ГПа (1 атм) называют стандартной теплотой образования
∆f Н0. В справочниках значение этой величины дается для температуры
298 К и обозначается 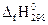 . Теплота образования простых веществ принята равной нулю.
. Теплота образования простых веществ принята равной нулю.
Теплотой сгорания называется тепловой эффект реакции полного сгорания данного соединения в чистом кислороде до наивысших оксидов элементов, входящих в состав сложного соединения − углекислого газа, водяных паров и других соединений.
Из закона Гесса вытекает ряд важных следствий, применение которых упрощает многие термохимические расчеты. Основные из них:
|
|
|
1. Тепловой эффект химической реакции равен разности алгебраических сумм теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
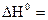
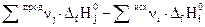 , (1.8)
, (1.8)
где индекс i относится к исходным веществам, а индекс j– к продуктам реакции.
2.Тепловой эффект химической реакции равен разности алгебраических сумм теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов.
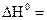
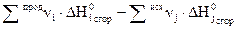 . (1..9)
. (1..9)
Значения стандартных теплот образования и теплот сгорания веществ имеются в таблицах термохимических величин. Для расчета тепловых эффектов реакций при температурах, отличных от 298 К, пользуются уравнением Кирхгофа:
 , (1.10)
, (1.10)
где 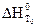 – тепловой эффект химической реакции при температуре Т0 (298 К);
– тепловой эффект химической реакции при температуре Т0 (298 К); 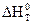 – тепловой эффект при любой температуре Т;
– тепловой эффект при любой температуре Т; 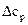 – разность молярных изобарных теплоемкостей продуктов и исходных веществ с учетом стехиометрических коэффициентов:
– разность молярных изобарных теплоемкостей продуктов и исходных веществ с учетом стехиометрических коэффициентов:
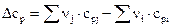 .
.
|
|
|


