 |
Катаболизм пиримидиновых нуклеотидов
|
|
|
|
В отличие от пуринов, кольцевая структура пиримидинов разрушается с образованием обычных конечных продуктов катаболизма - b-аминокислот, аммиака и двуокиси углерода. В катаболизме пиримидиновых нуклеотидов принимают участие нуклеотидазы и пиримидиновые нуклеотид фосфорилазы, которые превращают мононуклеотиды в свобоные основания. Аминогруппы цитозина и 5-метилцитозина отделяется в форме аммиака..
Д  ециклизация. Свободные пиримидиновые основания восстанавливаются
ециклизация. Свободные пиримидиновые основания восстанавливаются
Основные пути катаболизма пиримидиновых азотистых оснований
НАДФН+Н+. Атомы N2 и C3 пиримидинового кольца выделяются в форме аммиака и двуокиси углерода соответственно. Оставшаяся часть кольца представляет собой b-аминокислоту. b -аминоизомасляная кислота образуется из тимина или 5-метилцитозина и в основном затем выделяется почками. Незначительная часть ее после переаминирования может превращаться в сукцинил-КоА и использоваться в цикле трикарбоновых кислот. Из цитозина и урацила образуется b-аланин, который может быть использован для синтеза биологически активных дипептидов карнозина (гис-b-ала) или ансерина (метил гис-b-ала) в мозге и мышцах.
Экзаменационный билет №17
1.Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты, биологическое значение процесса.
2. Трансляция. Образование ППЦ. Этапы.
Задача.
Больной жалуется на неутолимую жажду. Суточный объём мочи – 4,5 л, плотность – 1004 кг/м3. Глюкоза и кетоновые тела в моче не обнаружены. При каком заболевании может быть такая клиническая картина? Какова возможная причина таких симптомов?
Дезаминирование – процесс удаления аминогруппы из аминокислот и выделение ее в виде аммиака. Углеродный скелет аминокислоты превращается в кетокислоту. Трансаминирование и дезаминирование протекает в клетке одновременно и часто ключевой молекулой является глутамат.
|
|
|
В природе известны четыре основных типа дезаминирования.
Восстановительное дезаминирование:
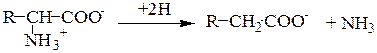
Гидролитическое дезаминирование:
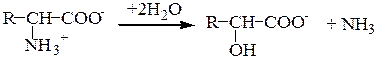
Внутримолекулярное дезаминирование:
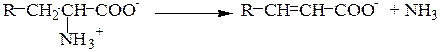
Окислительное дезаминирование:

Первые три типа дезаминирования характерны для ряда микроорганизмов, иногда встречаются у растений. Для животных, растений и большинства аэробных микроорганизмов преобладающим типом реакции является окислительное дезаминирования аминокислот.
7.1. Окислительное дезаминирование аминокислот. Значение окислительного дезаминирования состоит в выделении аммиака, который используется для синтеза мочевины, и образования α-кетокислот для различных метаболических процессов: глюконеогенеза, синтеза жирных кислот, заменимых аминокислот и окисления до углекислоты и воды с образованием энергии.
1. У животных и человека процесс локализован в пероксисомах клеток, главным образом, печени и почек.
2. Реакции дезаминирования катализируется ферментами L- и D-оксидазами.
3. L- и D-оксидазы являются флавопротеинами с простетическими группами ФМН и ФАД, соответственно.
4. Оксидазы L-аминокислот активны при рН 10 и при физиологических значениях рН (7,4) их активность в десять раз ниже (рис. 20.5). Поэтому прямого окислительного дезаминирования L-аминокислот в пероксисомах практически не происходит (за исключением L-лизина).

Рис. 20.5. Оксидаза L-аминокислот
5. В тканях при физиологических значениях рН активны оксидазы D-аминокислот. Но в клетках млекопитающих нет D-аминокислот. Роль оксидаз D-аминокислот не понятна. Предполагают, что эти ферменты необходимы: 1) для обезвреживания D-аминокислот, случайно проникших во внутреннюю среду организма с микроорганизмами; 2) при развитии опухолей возможно появление D-аминокислот в тканях, а, следовательно, появление аномальных белков после включения D-аминокислот в первичную структуру синтезируемых белков.
|
|
|
|
|
|


