 |
Регуляция синтеза и секреции
|
|
|
|
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
· первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
· вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
|
|
|
6. Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
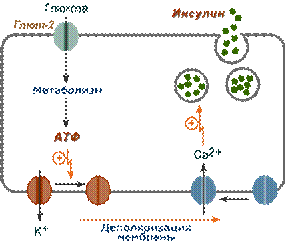
Схема внутриклеточной регуляции синтеза инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и других гормоны, нервная регуляция.
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы. При гипогликемии они оказывают обратный эффект, подавляя экспрессию гена инсулина.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
|
|
|
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина контролируется n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Мишени
К органам-мишеням инсулина можно отнести все ткани, имеющие к нему рецепторы. Рецепторы инсулина находятся практически на всех клетках, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. тот просто не проникает через гематоэнцефалический барьер.
Наибольшая их концентрация наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты - только 40 рецепторов на клетку.
Механизм действия
Рецептор инсулина представляет собой гликопротеин, построенный из двух димеров, каждый из которых состоит из α- и β-субъединиц, (αβ)2. Обе субъединицы кодируются одним геном 19 хромосомы и формируются в результате частичного протеолиза единого предшественника. Период полужизни рецептора составляет 7-12 часов.
При связывании инсулина с рецептором изменяется конформация рецептора и они связываются друг с другом, образуя микроагрегаты.
Связывание инсулина с рецептором инициирует ферментативный каскад реакций фосфорилирования. Первым делом аутофосфорилируются тирозиновые остатки на внутриклеточном домене самого рецептора. Это активирует рецептор и ведет к фосфорилированию остатков серина на особом белке, называемом субстрат инсулинового рецептора (СИР, или чаще IRS от англ. insulin receptor substrate). Таких IRS выделяют четыре типа – IRS‑1, IRS‑2, IRS‑3, IRS‑4. Также к субстратам инсулинового рецептора относят белки Grb-1 и Shc, которые отличаются от IRS аминокислотной последовательностью.
|
|
|
|
|
|


