 |
Кислотно-основная классификация катионов по группам
|
|
|
|
Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований – 1)хлороводородной кислоты HCl, 2)серной кислоты H2SO4, 3) гидроксидов натрия NaOH или калия KOH (в присутствии пероксида водорода H2O2) и 4)аммиака NH3. Эта классификация менее совершенна, чем сероводородная, и разработана менее детально, однако при ее использовании не требуется получение и применение токсичного сероводорода.
Полная схема систематического анализа катионов по этой классификации (как и по любой другой) практически никогда не применяется при контроле лекарственных средств и лекарственного сырья, однако отдельные элементы ее иногда используется в фармацевтическом анализе.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп (см. таблицу).
| Группа | Катионы | групповой реагент |
| I | Li+, Na+, K+, NH4+ | Нет |
| II | Ag+, Hg22+, Pb2+ | Растворы HCl |
| III | Ca2+, Sr2+, Ba2+ | Растворы H2SO4 |
| IV | Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+ | Раствор NaOH в присутствии H2O2 |
| V | Mg2+, Sb3+, Sb5+, Bi3+, Mn2+, Fe2+, Fe3+ | Раствор NaOH или раствор аммиака (25%) |
| VI | Cu2+, Cd2+, Hg2+, Co2+, Ni2+ | Раствор аммиака (25%) |
Контрольные вопросы и задания по теме занятия
1. Что изучает качественный химический анализ? Перечислите методы качественного анализа по величине навески.
2. Что называют групповым реагентом? Приведите примеры. Какие аналитические классификации катионов по группам существуют?
3. Какие групповые реагенты используют в кислотно-основной классификации катионов?
4. Каковы аналитические реакции катионов I аналитической группы?
5. В чем сущность систематического анализа смеси катионов I аналитической группы?
|
|
|
Основная литература:
1. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. шк., 2008. – 288 – 295 с., 320 – 324 с.
Дополнительная литература:
1. Основы аналитической химии. Практическое руководство. Учеб. пособие для вузов [Текст] / Под ред. Ю.А. Золотова - М.: Высш. шк., 2001. – 16 – 25 с.
Тема 4
Применение некоторых положений теории растворов электролитов и закона действующих масс в аналитической химии.
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Лабораторная работа № 2 “Качественные реакции катионов II аналитической группы: Ag+, Pb2+, Hg2+ . Анализ смеси катионов II группы”
5. Подведение итогов занятия
УЧЕБНЫЕ ЭЛЕМЕНЫ ТЕМЫ
Электролиты – это вещества, способные распадаться на ионы в растворах. Правда, такая формулировка является менее общей и не охватывает твердые электролиты и расплавы электролитов.
Количественно ионизация электролита в растворе характеризуется степенью диссоциацииα, равной отношению числа продиссоциировавших молекул nдисс. к исходному числу молекул nисх.: α = nдисс. ∕ nисх.
Электролиты
|
|

Сильные электролиты в не слишком концентрированных растворах распадаются на ионы практически полностью. Это – растворимые соли, сильные кислоты, сильные основания.
Слабые электролиты в растворах диссоциированны частично. Это - слабые кислоты, слабые основания, комплексные соединения (их внутренняя сфера), некоторые соли ртути (II), например HgCl2, Hg(CN)2.
Общая концентрация ионов – это молярная концентрация растворенного электролита с учетом степени диссоциации на ионы и числа ионов, на которые диссоциирует молекула электролита в растворе.
|
|
|
Например:
1) NaCl
NaCl → Na+ + Cl-
Если исходная С NaCl = 0,1 моль/л, то
С Na+ = 0,1 моль/л, С Сl- = 0,1 моль/л.
2) Al2(SO4)3 → 2Al3+ + 3SO42-
Если исходная концентрация С Al2(SO4)3 = 0,1 моль/л, то
СAl3+ = 0,1*2 = 0,2 моль/л, CSO42- = 0,1*3 = 0,3 моль/л.
Активность ионов в растворе – это величина, подстановка которой вместо общей концентрации в термодинамические уравнения, описывающие свойства идеальных растворов, дает соответствующие опыту значения рассчитываемых величин для реальных растворов. Обозначают активность буквой а.
Активность связана с общей концентрацией с формальным соответствием:
a = f•c
где f – коэффициент активности.
Ионная сила раствора численно равна полусумме произведений концентрации каждого иона на квадрат его зарядового числа.
Ic = 0,5Σcizi2, где
сi – молярная концентрация раствора по i-тому иону,
zi – заряд i-того иона в растворе.
Рассчитаем ионную силу раствора для следующих электролитов:
1) Бинарный, сильный электролит К1+А1-, однозарядный:
КА → К+ + А-
СК+ = СА- = СКА = С
Ic = 0,5[CK+ * 12 + CA- *12] = 0,5[CK+*CA-] = 0,5*2C = C
Ic = C
2) Бинарный, сильный электролит К2+А2-, 2х зарядный:
КА → К2+ + А2-
CKA = C, C(K2+) = C(A2-) = CKA = C
Ic = 0,5[CK2+*22 + CA2-*22] = 0,5*4[CK2+ + CA2-] = 2[C + C] = 4C
Ic= 4C
3) Электролит типа КА2 (или К2А):
КА2 → К2+ + 2А-
CKA2 = C, CK2+ = C, CA- = 2C.
Ic = 0,5[CK2+*22 + CA-*12] = 0,5 [C*4 + 2C*2] = 3C
Ic = 0,5(C•22 + 2C•12) = 0,5•6C = 3C,
Ic = 3C
4) Электролит типа К3А (или КА3):
К3А → 3К+ + А3-
где CK3A = C, CK+ = 3C, CA- = C
Ic = 0,5[CK+*12 + CA3-*32] = 0,5[3C*1 + C*9] = 6C
Ic = 0,5(3C•12 + C•32) = 0,5•12C = 6C
Ic = 6C
Зависимость коэффициента активности иона от ионной силы водного раствора описывается уравнением:
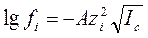
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Рассчитать ионную силу раствора, содержащего в 1 л 0,01 моль нитрата алюминия.
Решение:
Al(NO3)3→Al+3+3NO3-,т.к. нитрат алюминия -сильный электролит и полностью распадается на ионы. Тогда Ic=0,5∑Ci*Zi2
Ic=0,5(CAl+3*(+3)2+CNO3-*(1)2)= 0,5(0,01*9+0,03*1)=0,5(0,09+0,03)=0,5*0,12=0,06
где CAl+3=0,01 моль/л; CNO3- =0,03 моль /л.
Задача 2
Рассчитать ионную силу Ic раствора, полученного при смешивании равных объемов водных растворов сульфата аммония (NH4)2SO4, хлорида аммония NH4Cl и аммиака, если исходная концентрация всех трех растворов одинакова и равна 0,06 моль/л.
Решение:
Сульфат аммония и хлорид аммония в водном растворе – сильные электролиты и полностью распадаются на ионы.
(NH4)2SO4→2NH4+ +SO42-
|
|
|
NH4Cl→NH4+ + Cl-
Аммиак в водном растворе - слабый электролит, степень ионизации его незначительна, поэтому при расчете ионной силы раствора можно не учитывать ионы, образующиеся при ионизации аммиака. Следовательно, вклад в ионную силу раствора в данном случае вносят ионы NH4+, SO42- и Cl-
В соответствии с формулой (3.2) можно записать
Ic=0,5[c(NH4+*12+c(SO42-)*22+c(Cl-)*12]
Ионы аммония образуются при электролитической диссоциации сульфата и хлорида аммония, поэтому их концентрация поле смешивания растворов (разбавление растворов в три раза равна:
с(NH4+))=(0,060/3)*2+(0,060/3)*1=0,0060 моль/л
Концентрация сульфат-ионов и хлорид - ионов после смешивания растворов: с(SO42-)=0,060/3=0,020 моль/л; с(Сl)=0,060/3=0,020 моль/л.
Подставляя полученные значения концентраций в уравнение для Ic получаем:
Ic=0,5(0,060*12+0,020*22+0,020*12)=0,080 моль/л
|
|
|


