 |
Влияние различных факторов на комплексообразование в растворах.
|
|
|
|
А) Влияние рН среды. Изменение рН раствора влияет на процессы комплексообразования, особенно в тех случаях когда в реакциях образования комплексов или же в побочных реакциях лигандов участвуют ионы водорода.
Так, аммиачный комплекс серебра [Ag(NH3)2]+ может существовать в нейтральных и слабо щелочных растворах, тогда как в кислой среде он разрушается с выделением осадка хлорида серебра AgCl:
[Ag(NH3)2]+ + Cl- + 2H3O+ → AgCl ↓ + 2NH4+ + 2H2O
Тетрагидроксоаллюминат натрия также разрушается в кислой среде:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3↓ + H2O
Для полноты осаждения ионов металла в комплекс реакции комплексообразования проводят в слабо щелочной среде. При этом подавляется взаимодействие лигандов с ионами водорода.
Так часто L – это отрицательно заряженные ионы, т.е. анионы, которые могут связываться с ионами H+; поэтому реакции комплексообразования ведут в щелочной среде, OH- связывают ионы Н+:
Н+ + ОН- = Н2О
Возрастает равновесная концентрация лигандов, равновесие смещается вправо, т.е. увеличивается степень связывания ионов металла в комплекс. Однако в сильно щелочных средах комплексообразование обычно не проводят, чтобы избежать гидролиз ионов металлов и образования гидроксидов металлов.
Б) Влияние концентрации лиганда. Чем больше концентрация лиганда, тем полнее металл связывается в комплекс. Действительно, при увеличении концентрации лиганда L равновесие смещается вправо и концентрация «свободных» ионов металла уменьшается.
M + nL ↔ MLn
В) Влияние посторонних ионов, образующих малорастворимые соединения с металлом-комплексообразователем. Введение в растворы посторонних ионов иногда может привести к разрушению комплексов.
Рассмотрим, например, равновесия в растворе комплекса серебра [Ag(NH3)2]+ (без указания молекул воды, замещающих молекулы аммиака при их отщеплении из внутренней сферы комплекса):
|
|
|
[Ag(NH3)2]+ = [Ag(NH3)]+ + NH3 = Ag+ + 2NH3
Поскольку этот комплекс довольно устойчив (логарифм константы устойчивости β при комнатной температуре равен lg β = 7,21), то в обычных условиях равновесие сдвинуто влево – в сторону образования комплекса [Ag(NH3)2]+.
При введении в раствор иодид-ионов I- возможно выпадение осадка иодида серебра AgI вследствие протекания реакции
Ag+ + I- = AgI ↓
Поскольку произведение растворимости иодида серебра Кs0(AgI) = 8,3*10-17 очень мало – на несколько порядков меньше произведения растворимости хлорида серебра: Кs0(AgСl) = 1,78*10-10.
Г) Влияние ионной силы раствора. Ионная сила раствора также оказывает влияние на равновесия комплексообразования, поскольку с изменением ионной силы раствора изменяются равновесные активности ионов – участников реакций и, следовательно, соотношение между равновесными концентрациями реагентов.
Д) Влияние температуры. Константы устойчивости и нестойкости комплексов, как и любые другие константы химического равновесия, зависят от температуры, поэтому с изменением температуры равновесие комплексообразования смещается в ту или иную сторону.
Аналитическая классификация анионов.
| Аналитическая группа | Групповой реагент | Анионы |
| I | BaCl2 | B(OH)4-, SiO32-, CO32-, PO43-, AsO33-, AsO43-, SO42-, SO32-, S2O32-, F-, C2O42-, CrO42- |
| II | AgNO3 | S2-, Cl-, Br-, I-, IO3-, SCN- |
| III | Нет | NO3-, NO2-, CH3COO- |
Классификация анионов, основанная на их
Окислительно-восстановительных свойствах
| Группа | Анионы | Групповой реагент |
| I Окислители | BrO3-, AsO43-, 1NO3-, 2NO2- | Раствор KI в сернокислой среде |
| II Восстановители | S2-, SO32-, S2O32-, AsO33- | Раствор I2 в KI |
| S2-, SO32-, S2O32-, AsO33-, 2NO2-, 3C2O42-, 4Сl-, I-, Br-, CN-, SCN- | Раствор KMnO4 в сернокислой среде | |
| III Индифферентные | SO42-, CO32-, PO43-, CH3COO-, B4O72-, BO2- | Отсутствует |
|
|
|
1 Нитрат-ион NO3- в слабо кислой среде практически не реагирует с иодидом калия KI.
2 Нитрит-ион NO2- относят к I или II группе.
3 Оксалат-ион C2O42- заметно обесцвечивает раствор перманганата калия только при нагревании.
4 Хлорид-ион Сl- в обычных условиях медленно реагирует с раствором перманганата калия.
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Рассчитайте полную константу устойчивости β и полную константу нестойкости К нтетраммина цинка [Zn(NH3)4]2+ в водном растворе при 30 0C и ионной силе раствора Ic = 2, если логарифмы ступенчатых констант устойчивости в тех же условиях равны: lgβ1 = 2,37, lgβ2 = 2,44, lgβ3 = 2,50, lgβ4 = 2,15.
Решение:
Полная константа устойчивости β равна произведению ступенчатых констант устойчивости β = β1β2β3β4. Очевидно, что lgβ = lgβ1 + lgβ2 + lgβ3 + lgβ4 = 2,37 + 2,44 + 2,50 + 2,15 = 9,46, откуда β = 109,46 = 2,88 ∙ 109.
Полная константа нестойкости К н комплекса есть величина, обратная константе его устойчивости: К н = 1/ β = 10-9,46 = 3,5 ∙ 10-10.
Задача 2
Рассчитайте истинные термодинамические константы устойчивости β и нестойкости К н комплексного аниона [Co(NCS)4]2- в водном растворе, если равновесные активности ионов равны: a ([Co(NCS)4]2-) = 0,003, a (Co2+) = 0,080, a (NCS-) = 0,523.
Решение:
В растворе комплексный анион диссоциирует:
[Co(NCS)4]2- = Co2+ + 4NCS-
Истинная термодинамическая константа устойчивости
β = 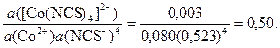
Истинная термодинамическая константа нестойкости К н = 1/β = 1/0,50 = 2. Комплекс в водных растворах неустойчив и равновесие существенно смещено вправо – в сторону его диссоциации.
|
|
|


