 |
Обмен липидов в нервной ткани имеет следующие особенности
|
|
|
|
1. мозг обладает высокий способностью синтезировать жирные кислоты;
2. в мозге практически не происходит?-окисления жирных кислот;
3. скорость липогенеза в головном мозге неодинакова в различные сроки постнатального периода;
4. постоянство состава липидов в зрелом мозге подтверждает низкую скорость их обновления в целом;
5. фосфатидилхолин и фосфатидилинозит обновляются в ткани мозга быстро;
6. скорость синтеза холестерола в мозге высока в период его формирования. С возрастом активность этого процесса уменьшается;
7. синтез цереброзидов и сульфатидов протекает наиболее активно в период миелинизации.
В зрелом мозге 90 % всех цереброзидов находятся в миелиновых оболочках, тогда как ганглиозиды – типичные компоненты нейронов.
Процесс апоптоза можно условно разделить на три фазы: сигнальную, эффекторную и деградационную.
Сигнальная фаза
Инициация апоптоза может происходить посредством внешних или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т. д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути трансдукции сигнала апоптоза: рецептор-зависимый сигнальный путь с участием рецепторов гибели клетки и митохондриальный путь.
Рецептор-зависимый сигнальный путь
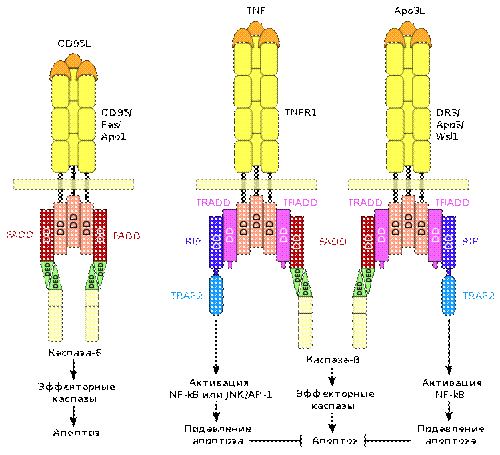
Схема передачи сигналов апоптоза при посредстве рецепторов смерти CD95, TNFR1 и DR3
Процесс апоптоза часто начинается с взаимодействия специфических внеклеточных лигандов с рецепторами клеточной гибели, экспрессированными на поверхности клеточной мембраны. Рецепторы, воспринимающие сигнал апоптоза, относятся к суперсемейству TNF-рецепторов. Наиболее изученными рецепторами смерти, для которых описана и определена роль в апоптозе, являются CD95 и TNFR1. К дополнительным относятся CARI, DR3, DR4 и DR5.
|
|
|
Все рецепторы смерти представляют собой трансмембранные белки, характеризующиеся наличием общей последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменом смерти и является необходимой для трансдукции сигнала апоптоза. Внеклеточные участки рецепторов смерти взаимодействуют с тримерами лигандов. Тримеры лигандов в результате взаимодействия тримеризуют рецепторы смерти. Активированный таким образом рецептор взаимодействует с соответствующим внутриклеточным адаптером. Для рецептора CD95 адаптером является FADD. Для рецепторов TNFR1 и DR3 адаптером является TRADD.
Адаптер, ассоциированный с рецептором смерти, вступает во взаимодействие с эффекторами — пока ещё неактивными предшественниками протеаз из семейства инициирующих каспаз — с прокаспазами. В результате цепочки взаимодействия «лиганд-рецептор-адаптер-эффектор» формируются агрегаты, в которых происходит активация каспаз. Данные агрегаты именуются апоптосомами, апоптозными шаперонами или сигнальными комплексами индуцирующими смерть. Примером апоптосомы может служить комплекс FasL-Fas-FADD-прокаспаза-8, в котором активируется каспаза-8.
Рецепторы смерти, адаптеры и эффекторы взаимодействуют между собой сходными по структуре доменами: DD, DED, CARD. DD участвует во взаимодействии рецептора Fas с адаптером FADD и во взаимодействии рецепторов TNFR1 или DR3 с адаптером TRADD. Посредством домена DED осуществляется взаимодействие адаптера FADD с прокаспазами −8 и −10. Домен CARD участвует во взаимодействии адаптера RAIDD с прокаспазой-2.
|
|
|
Посредством рецепторов смерти могут быть активированы три инициирующие каспазы: −2; −8 и −10. Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз.
Митохондриальный сигнальный путь
Митохондриальный сигнальный путь апоптоза реализуется в результате выхода апоптогенных белков из межмембранного пространства митохондрий в цитоплазму клетки. Высвобождение апоптогенных белков, предположительно, может осуществляться двумя путями: за счёт разрыва митохондриальной мембраны или же путём открытия высокопроницаемых каналов на внешней мембране митохондрий.

Модель образования апоптосомы «Цитохром c — Apaf-1 — CARD — прокаспаза-9». Активированная таким образом каспаза-9 рекрутирует прокаспазу-3, которая в свою очередь активируется до каспазы-3
Разрыв внешней мембраны митохондрий объясняется увеличением объема митохондриального матрикса. Данный процесс связывают с раскрытием пор митохондриальной мембраны, приводящим к снижению мембранного потенциала и высокоамплитудному набуханию митохондрий вследствие осмотического дисбаланса. Поры диаметром 2,6—2,9 нм способны пропускать низкомолекулярные вещества массой до 1,5 кДа. Раскрытие пор стимулируют следующие факторы: неорганический фосфат; каспазы; SH-реагенты; истощение клеток восстановленным глутатионом; образование активных форм кислорода; разобщение окислительного фосфорилирования протонофорными соединениями; увеличение содержания Ca в цитоплазме; воздействие церамида; истощение митохондриального пула АТФ и др.
В качестве альтернативного пути выхода апоптогенных белков из межмембранного пространства митохондрий рассматривается вариант образования белкового канала во внешней митохондриальной мембране. Так или иначе, в цитоплазму высвобождаются: цитохром c — белок с молекулярной массой 15 кДа; прокаспазы −2, −3 и −9; AIF — флавопротеин с молекулярной массой 57 кДа.
Цитохром c в цитоплазме клетки участвует в формировании апоптосомы вместе с белком Apaf-1. Предварительно, Apaf-1 претерпевает конформационные изменения в результате реакции, протекающей с затратой энергии АТФ. Предполагается, что трансформированный Apaf-1 приобретает способность связывать цитохром c. К тому же открывается доступ CARD-домена Apaf-1 для прокаспазы-9. В итоге происходит олигомеризация не менее 8 субъединиц трансформированного белка Apaf-1 с участием цитохрома c и прокаспазы-9. Так образуется апоптосома, активирующая каспазу-9. Зрелая каспаза-9 связывает и активирует прокаспазу-3 с образованием эффекторной каспазы-3. Высвобождающийся из межмембранного пространства митохондрий флавопротеин AIF является эффектором апоптоза, действующим независимо от каспаз.
|
|
|
Экзаменационный билет №23
1. Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
2.Апоптоз. Биологическое значение апоптоза. Роль белков Р-53 и ВС l -2. Лимит Хейфлика.
эробный распад протекает в условиях достаточного снабжения тканей кислородом.Он включает несколько стадий:
1. Аэробный распад глюкозы до двух молекул пирувата в гиалоплазме клеток,который можно разделить на 2 этапа:
а)подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз.
б) основной этап, сопряженный с синтезом АТФ. В результате серии реакций фосфотриозы превращаются в пируват.
- Превращение пирувата в ацетил-КоА и окисление последнего в цикле Кребса
- Дыхательная цепь
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с учас-тием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Это обратимая реакция изомеризации протекает при участии глюкозофосфатизомеразы. Затем следует еще одна реакция фосфорилирования за счет АТФ, катализирует ее фосфофруктокиназа. В ходе этой реакции фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Этот метаболит далее расщепляется на 2 триозофосфата: фосфоглицериноый альдегид (ФГА) и диоксиацетонфосфат (ДОАФ), реакцию катализирует альдолаза. В последующих реакциях гликолиза используется только ФГА, поэтому ДОАФ превращается с участием фермента триозофосфатизомеразы в ФГА. На этом подготовительный этап заканчивается.
|
|
|
Основной этап аэробного распада включает реакции, связанные с синтезом АТФ. Сна-чала происходит окисление ФГАпри участии ФГА-дегидрогеназы. Этот фермент является НАД+-зависимымым. Восстановленный НАД+ затем окисляется в дыхательной цепи (перенос НАДН в митохондрии, где находится дыхательная цепь, происходит при участии челночных механизмов, это связано с тем, что митохондриальная мембрана непроницаема для НАДН). Кроме того, свободная реакция окисления этой реакции концентрируется в макроэргической связи продукта реакции. Продуктом реакции является 1,3-бисфосфоглицерат. Для фосфорилирования используется Н3РО4. В следующей реакции высокоэнергетический фосфат передается на АДФ с образованием АТФ. Катализирует реакцию фосфоглицераткиназа. АТФ в данной реакции образуется путем субстратного фосфорилирования. Продуктом реакции является 3-фосфоглицерат. В следующей реакции происходит перенос фосфата из 3 положения во второе с образованием 2-фосфоглицерата. Из него при отщеплении воды образуется фосфоенолпируват – макроэргическое соединение, фосфатная группа которого в следующей реакции переносится на АДФ с образованием АТФ при участии пируваткиназы (это вторая реакция субстратного фосфорилирования). Продуктом реакции является пируват.
Во второй стадии пируват превращается в ацетил-КоА, который сгорает в цикле Кребса и дыхательной цепи (третья стадия) до СО2 и Н2О.
Всего при аэробном окислении глюкозы выделяется 32 АТФ.
Анаэробный гликолиз представляет собой распад глюкозы в анаэробных условиях(условиях недостаточного снабжения кислородом), поэтому он не зависит от работы митохондриальной дыхательной цепи. АТФ в гликолизе образуется путем субстратногофосфорилирования. Конечным продуктом является лактат (рис. 5).
Все реакции анаэробного гликолиза (11 реакций) протекают в гиалоплазме. Первые 10 реакций до пирувата идентичны аэробному распаду. В последней реакции происходит восстановление пирувата в лактат цитозольным НАДН. Реакцию эту катализирует лактатдегидрогеназа. С помощью этой реакции обеспечивается регенерация НАД+ из НАДН без участия дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от НАДН (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию НАД+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма (лактат – тупиковый метаболит). Он выводится в кровь и утилизируется: либо превращается в глюкозу (75%), либо при доступности кислорода окисляется до СО2 и Н2О (25%).
|
|
|
 Рис.5. Гликолиз
Рис.5. Гликолиз
Энергетический выход анаэробного гликолиза составляет 2 АТФ.
Недостатками анаэробного гликолиза являются: малый энергетический выход по сравнению с аэробным распадом и накопление лактата, что приводит к ацидозу, усталости.
Достоинства гликолиза: он полезен при выполнении кратковременной работы, является единственным источником энергии для эритроцитов (в них отсутствуют митохондрии), а также необходим в разных органах при дефиците кислорода (наложение жгута, падение давления, нарушение кровотока).
Регуляция. Регуляторными ферментами гликолиза являются:гексокиназа,фосфофруктокиназа и пируваткиназа. Аллостерическими ингибиторами являются АТФ и цитрат. Стимулирует гликолиз инсулин, а тормозят глюкагон, глюкокортикостероиды. Катехоламины тормозят гликолиз в печени и активируют в мышцах.
В клетках организма всегда существует потребность в глюкозе:
· для эритроцитов глюкоза является единственным источником энергии,
· нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
· глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза в организме демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
|
|
|


