 |
Растворы высокомолекулярных
|
|
|
|
СОЕДИНЕНИЙ
Первой стадией растворения любого полимера является его набухание - процесс поглощения полимером низкомолекулярной жидкости, сопровождающийся увеличением объема полимера и изменением конформаций его макромолекул.
Если процесс растворения самопроизвольно прекращается на стадии набухания, то говорят об ограниченном набухании, которое может быть обусловлено двумя причинами: ограниченным сродством полимера к растворителю и образованием сшитого полимера. Набухание характеризуют степенью набухания  , которую определяют как количество поглощенной полимером жидкости, отнесенное к единице массы или объема полимера:
, которую определяют как количество поглощенной полимером жидкости, отнесенное к единице массы или объема полимера:
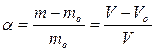 (7.1)
(7.1)
где mo, Vo - масса и объем исходного полимера; m, V - масса и объем набухшего полимера.
Скорость набухания лимитируется скоростью взаимной диффузии компонентов системы и для полимеров, находящихся в исходном высокоэластическом состоянии, обычно удовлетворительно описывается кинетическим уравнением первого порядка:
 (7.2)
(7.2)
где K – константа скорости набухания; αmax - максимальная степень набухания; ατ - степень набухания в момент времени τ.
После интегрирования этого уравнения получим:
 (7.3)
(7.3)
По тангенсу угла наклона прямолинейной зависимости ln(αmax – ατ) от времени можно определить константу скорости набухания.
В случае несшитых полимеров при изменении условий (температуры, концентрации и др.) ограниченное набухание может перейти в неограниченное, при этом макромолекулы диффундируют в растворитель вплоть до образования гомогенного раствора.
Одним из распространенных методов определения молекулярной массы высокомолекулярных соединения является осмометрический метод. В случае растворов полимеров уравнение состояния связывает осмотическое давление с температурой, концентрацией раствора и индивидуальными характеристиками компонентов. Приведенное осмотическое давление растворов полимеров описывается уравнением:
|
|
|
 (7.4)
(7.4)
где  - приведенное осмотическое давление, А1=1/M, А2, А3 – соответственно первый, второй, третий вириальные коэффициенты; M – молекулярная масса полимера.
- приведенное осмотическое давление, А1=1/M, А2, А3 – соответственно первый, второй, третий вириальные коэффициенты; M – молекулярная масса полимера.
Коэффициент А2 существенно зависит от природы растворителя и является удобной характеристикой термодинамического качества растворителя, т.е. термодинамического сродства к растворителя полимеру. В хороших растворителях А2 > 0, в плохих – А2 < 0. При А2 = 0 раствор полимера ведет себя как идеальный. Измеряя зависимость π от с и строя ее в координатах уравнения (7.4), можно определить значения М и А2.
Вискозиметрический метод определения молекулярной массы является наиболее простым из существующих методов.
Зависимость характеристической вязкости полимера в любом растворителе от молекулярной массы описывается Марка – Куна – Хаувинка:
 (7.5)
(7.5)
где М - молекулярная масса полимера; постоянная К =10-2-10-5 и зависит от температуры и природы полимера и растворителя.
Показатель степени α связан с конформацией макромолекулы в растворе и изменяется в пределах 0 < α < 2,0.
Характеристическая вязкость определяет поведение изолированных макромолекул. Она представляет собой меру потерь на трение изолированных макромолекул о растворитель при их вращении в результате поступательного движения в потоке с градиентом скорости, отличным от нуля. Характеристическая вязкость зависит от размеров макромолекул в растворе, природы растворителя и температуры раствора. В хорошем растворителе клубок набухает и вязкость увеличивается.
Оптический метод определения молекулярной массы основан на рассеянии света растворами ВМС. Дебаем был предложен метод определения молекулярной массы, основанный на измерении интенсивности рассеянного света (мутности) разбавленных растворов ВМС. Уравнение Дебая для оптического метода имеет вид:
|
|
|
 (7.6)
(7.6)
где А2 -второй вириальный коэффициент в уравнении состояния растворов полимеров (7.4); H –константа для данной системы полимер – растворитель;
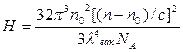 (7.7)
(7.7)
Для определения молекулярной массы измеряют мутность раствора для нескольких концентраций, строят график зависимости Hc/τ от концентрации, который представляет прямую линию. По величине отрезка, отсекаемого этой прямой на ординате [ Hc/τ ] находят величину, обратную величине молекулярной массы и вычисляют молекулярную массу ВМС.
 (7.8)
(7.8)
Найденное значение для полидисперсных ВМС представляет средневесовое значение молекулярной массы.
Метод Дебая применим только для определения молекулярной массы сравнительно низкомолекулярных полимеров, размер молекул которых не превышает 10-7 м, так как он должен быть меньше 1/20 длины волны рассеянного света. Это условие, однако, обычно соблюдается для растворов высокополимеров, в которых макромолекулы свернуты в клубок.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
1. При набухании бутадиен-стирольного каучука в веретенном масле получены следующие экспериментальные данные:
| τ, мин | ||||||
| m ×103,г | 3,684 | 8,657 | 11,605 | 15,473 | 19,525 | 20,0 |
t - время;
m – масса набухшего полимера
Определите графически константу скорости набухания К.
РЕШЕНИЕ При ограниченном набухании полимеров степень набухания изменяется во времени в соответствии с уравнением (7.2) и (7.3)
Зависимость ln(αmax – ατ ) от τ является линейной.
Рассчитываем данные для построения графика этой зависимости:
| τ, мин | |||||
| ατ | 1,33 | 2,15 | 3,2 | 4,3 | 4,43 |
| αmax–ατ | 3,1 | 2,28 | 1,23 | 0,13 | |
| ln (αmax–ατ) | 1,13 | 0,824 | 0,207 | -2,04 |
 |
Из графика (рис. 9) находим К. - К = tg
 К =6,45.10-3 мин-1
К =6,45.10-3 мин-1
Рис. 9. Определение константы скорости набухания каучука в веретенном масле.
2. Определите молекулярную массу поливинилхлорида и значение второго вириального коэффициента А2, используя экспериментальные данные, полученные методами светорассеяния. Величина постоянной Н = 6×10-13, растворитель циклогексан.
|
|
|
| Концентрация раствора с, кг/м3 | 1,69 | 2,12 | 2,66 | 3,26 | 3,75 |
| Мутность раствора τ ٠108, м-1 | 8,54 | 10,25 | 12,67 | 14,80 | 16,75 |
РЕШЕНИЕ По уравнению Дебая (7.6) мутность τ раствора полимера связана с его массовой концентрацией с и молекулярной массой М следующим образом:
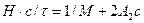
Рассчитываем значения H ٠ c/τ и строим их зависимость от c (рис.10).
| c,кг/м3 | 1,69 | 2,12 | 2,66 | 3,26 | 3,75 | |||
H.c/  .104,кг/м3 .104,кг/м3
| 1,19 | 1,24 | 1,26 | 1,32 | 1,34 |
Рис.10. Зависимость приведенной мутности от концентрации раствора полимера.
Экстраполируя зависимость на значение с = 0, находим 1/М = 1,05.104, М = 95238.
|
|
|



