 |
Практическая часть занятия
|
|
|
|
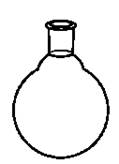
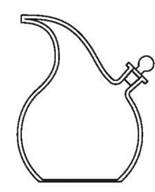
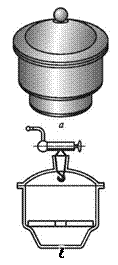
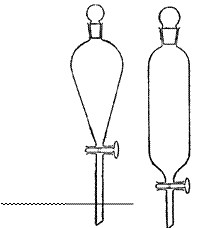
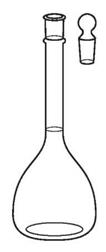
1. Обозначьте на рисунках:
1. бюретка
2. коническая колба
3. делительная воронка
4. эксикатор
5.  капельница
капельница
6. круглодонная колба
7. мерный цилиндр
8. пипетка Мора
9. химический стакан
10. мерная колба


 |  |  |  |

 |

 | |||
 |


 | |||||
 | |||||
 |
Что из перечисленного выше относится к мерной посуде?
______________________________________________________________________________________________________________________________________________________________________________________________________
Вывод: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата ________ Подпись преподавателя ______________
Методические указания
К занятию № 2.
Тема: Химический эквивалент. Закон эквивалентов.
Цель: Сформировать знания о химическом эквиваленте в кислотно-основных и окислительно-восстановительных реакциях.
Исходный уровень:
1.Основные понятия химии: молярная масса вещества, химическое количество вещества.
2. Количественные характеристики растворов: массовая доля, молярная концентрация.
Вопросы для обсуждения:
1. Способы выражения состава раствора.
2. Химический эквивалент вещества в кислотно-основных реакциях; фактор эквивалентности.
3. Химический эквивалент вещества в окислительно-восстановительных реакциях; фактор эквивалентности.
4. Молярная масса эквивалента, количество вещества эквивалента.
5. Молярная концентрация химического эквивалента вещества.
6. Закон эквивалентов, его использование в объемном анализе.
|
|
|
Рекомендуемая литература для подготовки:
1. Барковский Е.В. и др. Введение в химию биогенных элементов и химический анализ. Минск. «Высшая школа». 1997 с. 85-92.
2. Болтромеюк В.В. Общая химия. Гродно: ГГМУ, 2009. ст. 82-85.
3. Болтромеюк В.В. Физическая и коллоидная химия. Общая химия. Гродно: ГГМУ, 2010. ст.82-85
4. Бабков А.В. и др. Практикум по общей химии с основами количественного анализа. М., Высшая школа. 1978, § 18, с. 77-79.
Информационная часть занятия
Химический эквивалент.
Химическим эквивалентом называется условная или реальная частица вещества, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
В роли химического эквивалента может выступать молекула (формульная единица), атом или ион вещества. В этом случае эквивалент является реально существующей частицей. Но часто он представляет собой условную частицу, которая в целое число раз меньше молекулы (формульной единицы), атома или иона вещества.
Одному и тому же веществу Х может соответствовать несколько химических эквивалентов. Определить, что именно представляет собой химический эквивалент Х (реальную частицу или какую-то часть её), можно только, исходя из конкретной химической реакции, в которой это вещество участвует.
Число, показывающее, какую часть реальной частицы вещества Х составляет его химический эквивалент, называется фактором эквивалентности и обозначается  fэкв.(Х).
fэкв.(Х).
Фактор эквивалентности вещества является безразмерной величиной и определяется по формуле
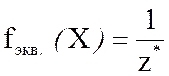
где z* – число эквивалентности вещества.
В реакциях ионного обмена для кислоты число эквивалентности равно числу ионов Н+, замещённых в её молекуле на ионы металла или NH4+.
У одноосновных кислот (HCl, HNO3, и т.д.) число эквивалентности всегда равно единице. Для многоосновных кислот (H3PO4, H2S и т.д.) оно может принимать несколько значений, в зависимости от количества замещенных ионов водорода в их молекулах.
|
|
|
Для основания в реакциях ионного обмена число эквивалентности равно количеству ионов ОН-, замещённых в его формульной единице на кислотные остатки.
У однокислотных оснований (КОН, NaOH и т.д.) число эквивалентности всегда равно единице. Многокислотные основания (Al(OH)3, Ba(OH)2 и т.д.) могут иметь несколько значений числа эквивалентности.
Для соли число эквивалентности равно произведению числа ионов металла (или NH4+), содержащихся в её формульной единице, на заряд одного такого иона.
В общем случае эквивалент любого вещества Х записывается следующим образом 1/z*(X).
Поясним вышесказанное на примере следующих реакций:
1) H3PO4 + 3KOH = K3PO4 + 3H2O
fэкв.(H3PO4)  =
= 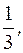 fэкв.(KOH) = 1
fэкв.(KOH) = 1
Химическими эквивалентами исходных веществ будут, соответственно:
1/3 (H3PO4) составляет 1/3 часть молекулы;
1(KOH) совпадает с формульной единицей вещества.
В реакции на одну молекулу Н3РО4 расходуется три формульных единицы КОН, но на 1·3 = 3 химических эквивалента Н3РО4 расходуется такое же количество химических эквивалентов (3·1 = 3) КОН.
2) H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
fэкв.(H3PO4)  =
=  fэкв.(Ca(OH)2) =
fэкв.(Ca(OH)2) = 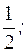
Химическими эквивалентами исходных веществ будут, соответственно:
 (H3PO4) составляет 1/2 часть молекулы;
(H3PO4) составляет 1/2 часть молекулы;
 (Ca(OH)2) составляет 1/2 часть формульной единицы.
(Ca(OH)2) составляет 1/2 часть формульной единицы.
В реакции на одну молекулу Н3РО4 расходуется одна формульная единица Ca(OH)2, но на 1·2 =2 химических эквивалента Н3РО4 расходуется такое же количество химических эквивалентов (1·2 = 2) Ca(OH)2.
3) Al(OH)3 + 2HCl = AlOHCl2 + 2H2O
fэкв.(Al(OH)3) =  fэкв.(HCl) = 1
fэкв.(HCl) = 1
Химическими эквивалентами исходных веществ будут соответственно:
 (Al(OH)3) составляет 1/2 часть формульной единицы;
(Al(OH)3) составляет 1/2 часть формульной единицы;
1(HCl) совпадает с молекулой вещества.
В реакции на одну формульную единицу Al(OH)3 расходуется две молекулы HCl, но на 1·2=2 химических эквивалента Al(OH)3 расходуется такое же количество химических эквивалентов (1· 2=2)HCl.
4) Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
fэкв.(Al2(SO4)3) = 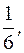 fэкв.(BaCl2) =
fэкв.(BaCl2) = 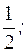
Химическими эквивалентами исходных веществ будут, соответственно:
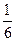 (Al2(SO4)3) составляет 1/6 часть формульной единицы;
(Al2(SO4)3) составляет 1/6 часть формульной единицы;
 (BaCl2) составляет 1/2 часть формульной единицы.
(BaCl2) составляет 1/2 часть формульной единицы.
|
|
|
В реакции на одну формульную единицу Al2(SO4)3 расходуется три формульных единицы BaCl2, но на 1·6=6 химических эквивалентов Al2(SO4)3 расходуется такое же количество химических эквивалентов (3·2 = 6) BaCl2.
Для вещества Х, участвующего в окислительно-восстановительной реакции (ОВР), z* является величиной, равной числу электронов, которые одна его молекула (формульная единица) присоединяет (если Х является окислителем) или отдаёт (если Х является восстановителем) в ходе реакции.
Например, в реакциях:
1) 3H2S-2 + 2 HN+5 O3 = 3S0 + 2N+2 O + 4 H2O
восстановитель окислитель
 |  |  |
S-2 - 2ē = S0 2 3
N+5 + 3ē = N+2 3 2
fэкв.(H2S)=  ; fэкв.(HNO3)=
; fэкв.(HNO3)= 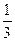 .
.
Химическими эквивалентами исходных веществ будут, соответственно:
 (H2S) составляет 1/2 часть молекулы,
(H2S) составляет 1/2 часть молекулы,
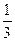 (HNO3) составляет 1/3 часть молекулы.
(HNO3) составляет 1/3 часть молекулы.
В реакции на три молекулы H2S расходуется две молекулы HNO3, но на 3·2=6 химических эквивалентов H2S расходуется такое же количество химических эквивалентов (2·3=6) HNO3.
2) 5H2C2+3O4+2KMn+7O4+3Н2SО4=10C+4O2+K2SO4+ 2Mn+2SO4 +8H2O
восстановитель окислитель
 |  | ||||
 | |||||
2С+3 - 2ē = 2С+4 2 5
Mn+7 + 5ē = Mn+2 5 2
fэкв.(H2C2O4)=  ; fэкв.(KMnO4) =
; fэкв.(KMnO4) = 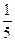 .
.
Химическими эквивалентами исходных веществ будут, соответственно:
 (H2C2O4) составляет 1/2 часть молекулы;
(H2C2O4) составляет 1/2 часть молекулы;
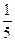 (KMnO4) составляет 1/5 часть формульной единицы.
(KMnO4) составляет 1/5 часть формульной единицы.
В реакции на пять молекул H2C2O4 расходуется две формульных единицы KMnO4, но на 5·2=10 химических эквивалентов H2C2O4 расходуется такое же количество химических эквивалентов (2·5=10) KMnO4.
3) 2С0 + 2HN+5 O3 = 2C+4O2 + N2+1O + H2O
восстановитель окислитель


 С0 - 4ē = С+4 4 2
С0 - 4ē = С+4 4 2
2N+5 + 8ē = 2N+1 8 1
fэкв.(С)= 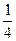 ; fэкв.(HNO3)=
; fэкв.(HNO3)= 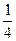 .
.
Химическими эквивалентами исходных веществ будут, соответственно:
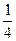 (С) составляет ¼ часть атома;
(С) составляет ¼ часть атома;
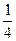 (HNO3) составляет 1/4 часть молекулы.
(HNO3) составляет 1/4 часть молекулы.
В реакции на два атома С расходуется две молекулы HNO3 и на 2·1=2 химических эквивалента С расходуется такое же количество химических эквивалентов (2·1=2) HNO3.
Количества прореагировавших молекул (формульных единиц) исходных веществ в большинстве химических реакций не относятся друг к другу как 1:1. Исключение составляют те случаи, когда в уравнении реакции перед формулами реагентов стоят одинаковые стехиометрические коэффициенты. Но в любой химической реакции количества расходованных химических эквивалентов исходных веществ равны между собой.
|
|
|
|
|
|


