 |
Окислительно-восстановительные реакции.
|
|
|
|
Окислительно-восстановительными реакциями (ОВР) называют химические процессы, сопровождающиеся переносом электронов от одних молекул или ионов к другим, в результате чего происходит изменение степени окисления элементов, входящих в соединения.
Степень окисления (С.О.)– это условный заряд атома элемента, вычисленный из предположения, что все связи в молекуле соединения являются ионными. При вычислении С.О. какого-либо элемента следует знать те элементы, которые в своих соединениях проявляют всегда одну степень окисления (табл. 3). В любой окислительно-восстановительной реакции имеют место два взаимосвязанных процесса: окисление и восстановление.
Окисление – процесс отдачи электронов атомом, молекулой или ионом. При окислении С.О. элемента повышается: Al0 – 3e- ® Al3+.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом. В этом случае С.О. элемента понижается: Fe3+ + 1 e- ® Fe2+.
Восстановители – это частицы (атомы, молекулы, ионы) которые отдают электроны, сами при этом они окисляются.
Окислители – это частицы, которые принимают электроны, сами при этом они восстанавливаются.
Таблица 3.
Элементы с постоянной степенью окисления
| С.О. | Элементы |
| Простые вещества | |
| +1 | H (кроме гидридов: CaH2, NaH), Щелочные металлы: Li, Na, K, Rb, Cs, Fr |
| +2 | Щелочно-земельные металлы: Be, Mg,Ca, Ba, Sr, а также d-элементы: Zn, Cd |
| +3 | B, Al |
| -2 | O (кроме H2O2 и OF2) |
Рассмотрим алгоритм составления уравнений ОВР методом электронного баланса, суть которого заключается в уравнивании числа электронов, отданных восстановителем, и числа электронов, принятых окислителем.
1. Записывают молекулярное уравнение реакции, например:
PbS + H2O2 ® PbSO4 +H2O
|
|
|
2. Определяют степени окисления атомов всех элементов в исходных веществах и продуктах реакции:
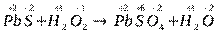
3. Находят элементы, атомы которых изменяют степени окисления. В данном случае это S и O.
4. Определяют окислитель и восстановитель. Записывают электронные схемы окисления и восстановления. Определяют процессы окисления и восстановления. Подбирают коэффициенты, на которые следует умножить уравнения электронного баланса перед их суммированием.
S  -2 – 8e- ® S+6 1 – окисление, восстановитель
-2 – 8e- ® S+6 1 – окисление, восстановитель
O-1 + 1e- ® O-2 8 – восстановление, окислитель
S-2 + 8O-1 ® S+6 + 8O-2
Z = –2+(–8) = –10 Z = +6+8 (–2)= –10
5. Составляют суммарное уравнение электронного баланса, в котором расставляют коэффициенты с учетом числа принятых и отданных электронов. Проверяют равенство зарядов: сумма зарядов в левой части уравнения должна совпадать с суммой зарядов в правой части.
6. Расставляют коэффициенты в уравнении реакции, соответствующие числу электронов, участвующих в процессе. Далее уравнивают число атомов, не участвующих в окислении-восстановлении: число атомов металлов, не изменивших С.О.; ионы кислотных остатков, не изменивших С.О.; число атомов водорода. Проверка правильности расстановки коэффициентов осуществляется подсчетом общего числа атомов кислорода слева и справа.
PbS + 4H2O2 ® PbSO4 +4H2O
Примеры решения задач
Пример 1. Определить степень окисления ванадия в молекуле Na4V2O7.
Р е ш е н и е. Суммарный заряд молекулы равен нулю. Атомы Na и O относятся к элементам с постоянной степенью окисления (табл. 3). Учитывая, что в молекуле Na4V2O7 4 атома натрия и 7 атомов кислорода, составляем уравнение:
4 (+1) + 2x + 7 (-2) =0, при решении которого находим, что степень окисления ванадия в указанном соединении равна +5: x = +5.
Пример 2. Определить степень окисления кремния в ионе SiO4-2.
Р е ш е н и е. В этом случае суммарный заряд соединения равен –4. Постоянная С.О. кислорода равна –2 (табл.3). Учитывая, что атомов кислорода в ионе SiO4 4- четыре, составляем и решаем уравнение: x+ 4 (-2) = –4, x = +4.
|
|
|
Пример 3. Определить, окислением или восстановлением являются данные переходы: а) H2O2 ® O2, б) MnO4- ® MnO2.
Р е ш е н и е. а) Расставляем степени окисления элементов, входящих в
состав соединений:
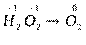
Данный переход представляет процесс окисления, так как происходит отдача электронов ионами кислорода: 2O-1 – 2e- ® O20
б) Расставляем степени окисления элементов, входящих в состав
соединений:
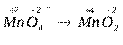 .
.
Данный переход представляет процесс восстановления, так как происходит присоединение электронов ионами марганца: Mn+7 + 3e- ® Mn+4.
Электролиз.
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита.
Электрод, на котором при электролизе происходит восстановление, называется катодом, а электрод, на котором происходит процесс окисления – анодом. При электролизе катод заряжен отрицательно, т. к. он присоединяется к отрицательному полюсу внешнего источника электричества. К положительному полюсу присоединяется электрод, на котором будет происходить реакция окисления. Применяются как металлические электроды, так и инертные.
При включении постоянного электрического тока катионы, находящиеся в растворе (или расплаве) электролита, начинают двигаться к катоду, а анионы – к положительно заряженному аноду. При достижении катионами поверхности катода на ней начинается процесс восстановления.
Возможные виды реакций, протекающих при электролизе на катоде:
1. электродный потенциал металла больше нуля (от Bi до Au), тогда его ионы практически полностью восстанавливаются;
2. электродный потенциал металла от 0 В до – 0,828 В (потенциал катодного восстановления воды с учетом всех побочных эффектов), тогда его ионы могут восстанавливаться одновременно с молекулами воды;
3. электродный потенциал ниже - 0,828 В, тогда восстанавливаются молекулы воды.
Электрохимическое восстановление воды в кислой среде происходит по уравнению:
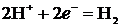
В случае нейтральной и щелочной сред вода восстанавливается по уравнению:

Анодные процессы сводятся к разрядке анионов, или к ионизации атомов (или молекул) материалов анода. В связи с этим выделяют электролиз с растворимыми анодами и электролиз с нерастворимыми анодами.
|
|
|
Возможные виды реакций, протекающих при электролизе на инертном аноде:
1. при электролизе растворов щелочей, кислородосодержащих кислот и их солей, фтороводорода, фторидов происходит электрохимическое окисление воды. В щелочной среде окисление идёт по уравнению:
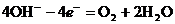
В кислой и нейтральной средах вода окисляется по уравнению:
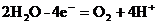
2. при электролизе водных растворов бескислородных кислот и их солей (кроме фтороводорода и фторидов) происходит окисление анионов.
Если анод металлический, происходит: электрохимическое окисление воды, окисление аниона, окисление металла анода. При этом если значение стандартного потенциала металла анода меньше, чем у предыдущих двух систем, то будет происходить анодное растворение металла.
Пример 1. Написать уравнения процессов, происходящих при электролизе водного раствора нитрата калия с инертным анодом.
Решение: Стандартный электродный потенциал системы 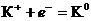
(Е0 = - 2,925 В) значительно отрицательнее потенциала водородного электрода в нейтральной водной среде (- 0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды по уравнению:

Ионы К+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора.
На аноде будет происходить электрохимическое окисление воды по уравнению:

Нитрат-ионы будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:

Учитывая, что одновременно происходит накопление ионов К+ в катодном пространстве и ионов 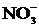 в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
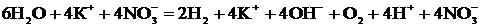
Т. о., одновременно с выделением водорода и кислорода образуется гидроксид калия (в катодном пространстве) и азотная кислота (в анодном пространстве).
Количественной характеристикой электролиза являются законы Фарадея:
|
|
|
1. Массы разрядившихся или образовавшихся на электродах ионов, т. е. массы выделившихся или перешедших в электролит веществ, пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и не зависят от других условий.
2. При прохождении через различные электролиты одинаковых количеств электричества на электродах выделяются массы веществ, пропорциональные их химическим эквивалентам.
 (1)
(1)
где m – масса вещества, окисленного или восстановленного на электроде; Мэ– молярная масса эквивалента; I – сила тока, А; t – продолжительность электролиза, сек.; F – постоянная Фарадея, численно равна 96500 Кл/моль.
Пример 2. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение: Согласно законам Фарадея 
Молярная масса эквивалентов меди в CuSO4 равна 63,54/2 = 31,77 г/моль. Подставив в формулу (1) значения
Мэ = 31,77 г/моль,
I = 4 А,
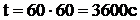 ,
,
получим
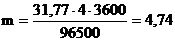
 .
. 
Пример 3. Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение: Из формулы (1)
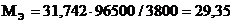

где m = 11,742 г;

Пример 4. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (нормальные условия)?
Решение: 
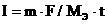
Так как дан объём водорода, то отношение m / Мэ заменяем отношением 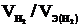 , где
, где  - объём водорода, л;
- объём водорода, л; 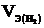 - эквивалентный объём водорода, л. Тогда
- эквивалентный объём водорода, л. Тогда

Эквивалентный объём водорода при нормальных условиях равен половине молярного объёма 22,4/2 = 11,2 л. Подставив в приведённую формулу значения  = 1,4 л,
= 1,4 л, 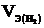 = 11,2 л, t = 6025 с (1 ч 40 мин 25 с = 6025 с), находим
= 11,2 л, t = 6025 с (1 ч 40 мин 25 с = 6025 с), находим
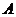
|
|
|


