 |
Электродные потенциалы и электродвижущие силы
|
|
|
|
Если погрузить металлическую пластинку в водный раствор соли того же металла, положительные ионы, находящиеся на поверхности металла, гидратируются и некоторое количество ионов переходит в раствор.
В результате этого перехода на пластинке образуется избыток электронов, она заряжается отрицательно. В то же время гидратированные ионы металла, находящиеся в растворе, отбирая у металлической пластины электроны, образуют атомы металла, которые становятся частью кристаллической решетки. Этот процесс приводит к дефициту электронов и возникновению на пластинке положительного заряда.
Таким образом, между металлическим электродом и раствором устанавливается состояние равновесия:

В зависимости от того, какой из двух рассмотренных процессов преобладает, зависит знак и величина заряда поверхности.
 Рис. 1. Образование двойного электрического слоя
Рис. 1. Образование двойного электрического слоя
|
Электрическое поле, возникающее вокруг электрода, вызывает неравномерное распределение ионов в растворе вблизи электрода. Если металлическая пластина заряжается отрицательно (рис.1), катионы, притягиваясь к поверхности, концентрируются вблизи нее. В результате раствор вблизи поверхности приобретает заряд, противоположный по знаку заряду металла - образуется двойной электрический слой.
Анионы отталкиваются от поверхности и их концентрация вблизи электрода будет понижена. Если поверхность металла заряжена положительно, наблюдается картина, обратная представленной на рис. 1.
Таким образом, при погружении металла в раствор, содержащий ионы этого же металла, на поверхности раздела фаз образуется двойной электрический слой и возникает определенный скачок потенциала, который принято называть электродным потенциалом.
|
|
|
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или (активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25° С условно принимается равным нулю (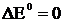 ;
; 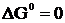 ).
).
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, получим электрохимический ряд напряжений металлов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pt, Au
В этом ряду слева направо происходит уменьшение химической активности металлов. Положение металлов в ряду напряжений позволяет предсказать возможность самопроизвольного протекания реакции.
Самопроизвольно могут протекать те реакции, в которых восстановитель имеет более электроотрицательный потенциал, чем окислитель.
Пользуясь этим правилом, нетрудно предсказать, что реакции


должны протекать самопроизвольно, а реакции


в прямом направлении протекать не могут.
Как отмечалось выше, знак и величина потенциала зависит от положения равновесия между металлом и раствором. Электродный потенциал зависит от следующих основных факторов:
1) От природы металла. Чем большей химической активностью обладает данный металл, т. е. чем легче он растворяется, тем в большей степени равновесие смещено вправо - тем отрицательнее потенциал.
2) От концентрации ионов металла в растворе. Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево и потенциал становится более положительным.
3) От температуры. С повышением температуры потенциал становится более положительным, т. е. равновесие смещается влево. Чтобы понять причины этого эффекта, необходимо учесть, что переход ионов в раствор связан с гидратацией, а гидратация — процесс экзотермический (действие принципа Ле Шателье).
|
|
|
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
Е=Е0 + (RT/nF)lg CMen+,
Где (RT/F)=0,059 при Т=298 К. Тогда уравнение принимает вид:
ЕМеn+/Me0=Е0 Меn+/Me0 + (0,059/n)lg CMen+,
Е0 Меn+/Me0 – стандартный электродный потенциал Ме;
n – число электронов, участвующих в электродном процессе;
CMen+ - концентрация ионов металла, моль/л (молярная концентрация).
R - универсальная газовая постоянная равная 8,314 Дж/моль·К;
Т - температура по шкале Кельвина;
F - постоянная Фарадея, единица количества электричества, равная 96484 Кл/моль.
Гальванический элемент представляет собой электрохимическую систему, состоящую из двух электродов (любого типа), растворы которых соединены с помощью солевого мостика. Рассмотрим гальванический элемент, состоящий из двух электродов первого рода: цинкового и медного. На рис. 2 представлена схема такого элемента.
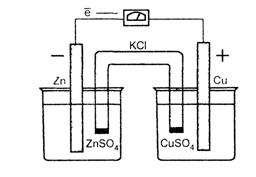 Рис. 2. Гальванический элемент
Даниеля-Якоби
Рис. 2. Гальванический элемент
Даниеля-Якоби
| Растворы сульфатов цинка и меди соединены между собой солевым мостиком - стеклянной трубкой, заполненной раствором хлорида калия. Солевой мостик препятствует смешиванию растворов, проводит электрический ток. Пока цепь разомкнута, на каждом из электродов существуют равновесия:


|
Поскольку цинк является металлом имеющим наиболее электроотрицательный потенциал, чем медь 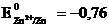
 ,
, 
 , первое равновесие по сравнению со вторым смещено вправо, следовательно, на цинковом электроде имеется избыток электронов. Соединим металлические пластины проводником. Электроны будут перемещаться с цинковой пластины на медную - в цепи пойдет электрический ток, равновесие на электродах нарушится. В соответствии с принципом Ле Шателье, на электродах начнутся процессы, способствующие восстановлению равновесия (т. е. появлению на цинковом электроде избытка электронов):
, первое равновесие по сравнению со вторым смещено вправо, следовательно, на цинковом электроде имеется избыток электронов. Соединим металлические пластины проводником. Электроны будут перемещаться с цинковой пластины на медную - в цепи пойдет электрический ток, равновесие на электродах нарушится. В соответствии с принципом Ле Шателье, на электродах начнутся процессы, способствующие восстановлению равновесия (т. е. появлению на цинковом электроде избытка электронов):
А (-)  окисление
окисление
К (+)  восстановление
восстановление
Таким образом,
В любом замкнутом гальваническом элементе на отрицательном электроде, называемом анодом, происходит окисление, а на положительном электроде – катоде - восстановление.
|
|
|
Поскольку цепь замкнута, избыточные электроны будут перетекать на медную пластину и т. д. До тех пор, пока цепь будет замкнута, цинковая пластина будет растворяться, на медной будет осаждаться металлическая медь. Равновесие на электродах не установится, в цепи будет протекать ток. Просуммируем процессы, протекающие на электродах в замкнутом гальваническом элементе:

или

Суммарная электрохимическая реакция называется токообразующей. Рассмотренный гальванический элемент называется элементом Даниэля - Якоби. В прошлом веке он широко использовался в качестве источника постоянного тока. Сокращенное обозначение элемента Даниэля-Якоби: А (-)  //
//  (+) К
(+) К
Подобным образом обозначают любые гальванические элементы. При этом следует помнить, что слева принято указывать электрод с более отрицательным потенциалом.
Гальванический элемент – это система, в которой происходитсамопроизвольная окислительно-восстановительная реакция (< 0), энергия которой превращается в электрическую энергию.
Гальванический элемент является химическим источником электрического тока.
Основной характеристикой гальванического элемента является его электродвижущая сила (ЭДС) или  , которая представляет собой разность электродных потенциалов в исходный момент работы элемента. ЭДС всегда является величиной положительной.
, которая представляет собой разность электродных потенциалов в исходный момент работы элемента. ЭДС всегда является величиной положительной.
Чтобы рассчитать величину ЭДС, необходимо вычесть из более положительного электродного потенциала величину более отрицательного потенциала. В нашем примере при концентрации ионов цинка и меди в растворах равных 1 моль/л:

Гальванический элемент может быть составлен не только из электродов, состоящих из разных металлов, но и из электродов одного металла, погруженных в растворы одного и того же электролита, но с различной концентрацией ионов. Такой гальванический элемент называется концентрационным. Поскольку ЭДС обусловлена только разностью концентраций ионов металла в растворах.
Составим гальванический элемент из двух серебряных пластинок, погруженных в растворы нитрата серебра разных концентраций 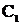 и
и  .
.
|
|
|
А (-) 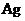 /
/ 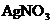 //
//  /
/ 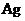 (+) К
(+) К
 <
< 
ЭДС такого элемента может быть определена по формуле:

При работе этого элемента протекают следующие процессы:
А (-)  окисление
окисление
К (+) 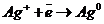 восстановление
восстановление
Таким образом, концентрация первого раствора  будет постепенно увеличиваться, а второго раствора
будет постепенно увеличиваться, а второго раствора  уменьшаться, следовательно, ЭДС будет уменьшаться. Через некоторое время концентрации
уменьшаться, следовательно, ЭДС будет уменьшаться. Через некоторое время концентрации 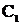 и
и  станут одинаковыми, а ЭДС - равной нулю.
станут одинаковыми, а ЭДС - равной нулю.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта. Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,1 моль/л?
Решение: Электродный потенциал металла (Е) зависит от концентрации в растворе. Эта зависимость выражается уравнением Нернста:
где 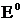 - стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/n;
- стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/n; 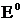 для никеля и кобальта соответственно равны - 0,25 и - 0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
для никеля и кобальта соответственно равны - 0,25 и - 0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях: 


Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2.Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение: Подобные задачи так же решаются на основании уравнения Нернста (см. пример 1):





Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающий в этом гальваническом элементе, и вычислите его ЭДС.
Решение: Схема данного гальванического элемента
(-)  //
//  (+)
(+)
Наклонная линия обозначает поверхность между металлом и раствором, а две наклонные линии – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 B) и является анодом, на котором протекает окислительный процесс:

Цинк, потенциал которого (– 0,763 В) - катод, т. е. электрод, на котором протекает восстановительный процесс:

Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
|
|
|
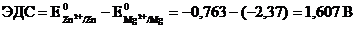 Коррозия металлов
Коррозия металлов
Поверхность изделий и сооружений из металлов при соприкосновении с окружающей средой подвергается механическому и химическому воздействию.
Коррозия – это самопроизвольный процесс, который является следствием гетерогенной окислительно-восстановительной реакции металла с компонентами окружающей среды. В результате коррозии образуются продукты окисления металла – оксиды, гидроксиды, иногда просто растворяющиеся в среде ионы. Такое превращение металла сопровождается изменением его механических свойств. Таким образом, коррозия сопровождается потерей металла, причем продукты коррозии, как правило, не могут быть в какой-то мере использованы.
Коррозионные процессы классифицируют:
· по виду (геометрическому характеру) коррозионных разрушений на поверхности или в объёме металла;
· по механизму реакций взаимодействия металла со средой (химическая и электрохимическая коррозия);
· по типу коррозионной среды;
· по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный – окисление металла

и катодный - восстановление ионов водорода

или молекул кислорода, растворённого в воде

Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение: Цинк имеет более отрицательный потенциал (- 0,763 В), чем кадмий (- 0,403 В), поэтому он является анодом, а кадмий катодом.
анодный процесс:

катодный процесс:
 в кислой среде
в кислой среде
 в нейтральной среде
в нейтральной среде
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2.
|
|
|


