 |
Пассивный транспорт веществ и его разновидности. Математическое описание пассивного транспорта
|
|
|
|
Пассивный транспорт веществ через клеточные мембраны включает в себя следующие разновидности: фильтрацию, простую диффузию и облегченную диффузию (см. рис. 19.6).

Простая диффузия – процесс переноса вещества из области с большей концентрацией в область меньшей концентрации. Диффузия описывается уравнением Фика:
 ,
,
где  вектор плотности потока массы диффундирующего вещества, направлен в сторону переноса.
вектор плотности потока массы диффундирующего вещества, направлен в сторону переноса.  - масса вещества, переносимая в единицу времени вследствие диффузии через выделенную единичную площадку, ориентированную перпендикулярно вектору плотности потока.
- масса вещества, переносимая в единицу времени вследствие диффузии через выделенную единичную площадку, ориентированную перпендикулярно вектору плотности потока.
 .
.
 - вектор градиента концентрации диффундирующего вещества, вектор градиента направлен в сторону возрастания концентрации, в декартовой системе координат выражение
- вектор градиента концентрации диффундирующего вещества, вектор градиента направлен в сторону возрастания концентрации, в декартовой системе координат выражение  имеет вид:
имеет вид:
 .
.
где 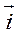 ,
,  ,
,  - единичные векторы, направленные вдоль осей OX, OY, OZ.
- единичные векторы, направленные вдоль осей OX, OY, OZ.  .
.
D – коэффициент диффузии, зависит от температуры и свойств диффундирующего вещества.  .
.
Таким образом, вектор плотности потока вещества при диффузии направлен в сторону, противоположную вектору градиента концентрации диффундирующего вещества (см. рис. 19.7).


В медицинской литературе традиционно принято считать, что вектор градиента концентрации направлен в сторону уменьшения концентрации вещества. В дальнейшем изложении материала мы будем придерживаться этого нетрадиционного определения направления вектора градиента (еретичного для математической теории поля, в рамках которой было сформулировано понятие вектора градиента поля).
Если имеет место одномерная диффузия, т.е. перенос вещества осуществляется вдоль одной оси, например, оси ОХ, в выбранной системе координат, то уравнение Фика может быть представлено в скалярной форме:
|
|
|

Уравнение Фика, адаптированное к условиям переноса вещества через биологическую мембрану посредством простой диффузии, имеет вид (см. рис. 19.8):
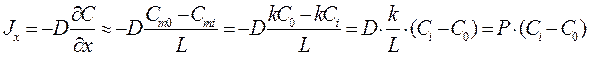 ,
,
где Сi и C0 – концентрации диффундирующего вещества внутри и вне клетки. Сmi и Cm0 – концентрации диффундирующего вещества внутри мембраны на границе мембрана - внутреннее содержимое клетки и мембрана - внешняя среда. L - толщина мембраны, D – коэффициент диффузии, k – коэффициент распределения молекул диффундирующего вещества, равный отношению концентрации молекул на границе мембраны и вне ее, P=Dk/L – проницаемость мембраны. Проницаемость мембраны определяется как свойствами диффундирующего вещества (коэффициентом диффузии), так и состоянием мембраны.

Электродиффузия. Диффузия заряженных частиц, ионов, через мембраны зависит не только от концентрационного градиента, но и от электрического градиента мембраны, то есть от напряженности в ней электрического поля (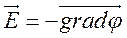 ,
,  ).
).
В связи с этим перенос ионов может происходить в направлении, противоположном градиенту концентрации. Совокупность концентрационного и электрического градиентов называют электрохимическим градиентом.
Поток вещества при электродиффузии определяется уравнением Нернста-Планка:
 (векторная форма),
(векторная форма),
 (проекция векторных величин на ось ОХ),
(проекция векторных величин на ось ОХ),
где g - константа электрического переноса.
Облегченная диффузия. Путем простой диффузии в клетку поступают немногие вещества (например, кислород, СО2) Этот процесс протекает очень медленно и обусловлен лишь разностью концентраций этих веществ. Особенностью биомембран является их избирательность (селективность) по отношению ко многим переносимым веществам.
Селективность мембран обусловлена двумя причинами: наличием в них переносчиков, называемых ионофорами (подвижных и фиксированных) и каналов.
Облегченная диффузия – процесс транспорта веществ с помощью специальных молекул-переносчиков. Например, на внешней стороне мембраны переносчик соединяется с некоторым веществом и проникает через мембрану. На внутренней стороне мембраны происходит отделение от вещества переносчика, который возвращается к внешней поверхности мембраны (см. рис. 19.9). Рассмотренный пример облегченной диффузии относится к типу облегченной диффузии с подвижным переносчиком. Второй тип облегченной диффузии – диффузия с помощью фиксированных переносчиков. При диффузии с фиксированным переносчиком транспорт молекул переносимого вещества происходит с помощью неподвижных молекул-переносчиков (молекула переносимого вещества передается от одной молекулы переносчика к другой, как по эстафете).
|
|
|

Фильтрация. Фильтрация представляет собой перенос молекул растворителя под действием градиента давления. Таким образом, причиной и движущей силой в процессе фильтрации является разность давлений. Объем растворителя, перенесенного в результате фильтрации, определяется формулой Пуазейля:
 ,
,
где  - перепад давления на расстоянии
- перепад давления на расстоянии  ,
,  - вязкость жидкости,
- вязкость жидкости,  - радиус поверхности фильтрации,
- радиус поверхности фильтрации,  - время переноса.
- время переноса.
Осмос. Осмос представляет собой диффузию молекул растворителя через полупроницаемую пленку из области с меньшей концентрацией раствора в область большей концентрации.

Явление осмоса наблюдается, когда два соляных раствора с разными концентрациями разделены полупроницаемой мембраной. Полупроницаемая мембрана пропускает молекулы и ионы определенного размера, но служит барьером для веществ с молекулами большего размера. Например, молекулы воды способны проникать через мембрану, а молекулы растворенных в воде солей - нет.
Если по разные стороны полупроницаемой мембраны находятся растворы солей с разной концентрацией (см. рис. 19.10), то молекулы воды (растворителя) будут перемещаться через мембрану из слабо концентрированного раствора в более концентрированный, вызывая в последнем повышение уровня жидкости. Из-за явления осмоса процесс проникновения воды через мембрану наблюдается даже в том случае, когда оба раствора находятся под одинаковым внешним давлением.
|
|
|
Разница в высоте уровней двух растворов разной концентрации пропорциональна силе, под действием которой вода проходит через мембрану. Эта сила называется "осмотическим давлением". Таким образом, осмотическое давление возникает в растворах с разной концентрацией, разделенных полупроницаемой мембраной, градиент осмотического давления направлен из раствора меньшей концентрации в сторону раствора с большей  концентрацией[1].
концентрацией[1].
 Проделаем следующий опыт. В воронку, раструб которой затянут бычьим пузырем (бычий пузырь обладает полупроницаемыми свойствами – пропускает молекулы воды и не пропускает молекулы сахара), нальем слабый водный раствор сахара и опустим в сосуд с чистой водой так, чтобы уровни жидкостей в воронке и сосуде совпали. Через некоторое время уровень раствора в воронке начнет медленно повышаться (см. рис. 19.11). Процесс продолжится до тех пор, пока гидростатическое давление столба жидкости высотой h не будет препятствовать дальнейшему поступлению воды из сосуда. Величина гидростатического давления, создаваемого столбом жидкости высотой h, равна rgh, где g – ускорение свободного падения, r - плотность жидкости. Давление, уравновешивающее гидростатическое, называется осмотическим давлением. Повышение уровня раствора в воронке происходит по следующей причине: так как концентрация молекул воды в сосуде больше концентрации молекул воды в воронке, то через полупроницаемую перегородку диффундируют молекулы воды из сосуда в воронку. Молекулы же сахара не могут перейти из воронки в сосуд. Пусть молярная концентрация молекул сахара в сосуде равна нулю, а в воронке С. Избыточная концентрация молекул сахара и создаст парциальное давление растворенного вещества, уравновешиваемое гидростатическим давлением ρgh.
Проделаем следующий опыт. В воронку, раструб которой затянут бычьим пузырем (бычий пузырь обладает полупроницаемыми свойствами – пропускает молекулы воды и не пропускает молекулы сахара), нальем слабый водный раствор сахара и опустим в сосуд с чистой водой так, чтобы уровни жидкостей в воронке и сосуде совпали. Через некоторое время уровень раствора в воронке начнет медленно повышаться (см. рис. 19.11). Процесс продолжится до тех пор, пока гидростатическое давление столба жидкости высотой h не будет препятствовать дальнейшему поступлению воды из сосуда. Величина гидростатического давления, создаваемого столбом жидкости высотой h, равна rgh, где g – ускорение свободного падения, r - плотность жидкости. Давление, уравновешивающее гидростатическое, называется осмотическим давлением. Повышение уровня раствора в воронке происходит по следующей причине: так как концентрация молекул воды в сосуде больше концентрации молекул воды в воронке, то через полупроницаемую перегородку диффундируют молекулы воды из сосуда в воронку. Молекулы же сахара не могут перейти из воронки в сосуд. Пусть молярная концентрация молекул сахара в сосуде равна нулю, а в воронке С. Избыточная концентрация молекул сахара и создаст парциальное давление растворенного вещества, уравновешиваемое гидростатическим давлением ρgh.
Так как осмотическое давление есть результат бомбардировки полупроницаемой мембраны молекулами растворенного вещества (см. рис. 19.12), то величина осмотического давления может быть рассчитана по формуле идеального газа:
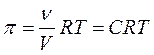 ,
,
где n - число молей растворенного вещества, V – объем раствора, С – молярная концентрация раствора.
|
|
|
Применение теории идеального газа к растворам позволило химику Вант-Гоффу получить прекрасные результаты для растворов многих веществ. Однако для растворов некоторых веществ полученные результаты между измеренными и расчетными значениями осмотических давлений давали расхождение в 2 и более раз. Осмысление возможных причин такого расхождения между теорией и практикой привело ученого С. Аррениуса к открытию явления диссоциации. Единомышленник Вант-Гоффа шведский исследователь С. Аррениус догадался, что если измеренное осмотическое давление раствора поваренной соли в два разе больше расчетного, то и число частиц в растворе в два раза больше, чем молекул NaCl.
Следовательно, величина осмотического давления прямо пропорциональна молярной концентрации растворенного в растворителе вещества, которое лишено возможности участвовать в диффузии вследствие наличия полупроницаемой мембраны и температуре раствора:
 ,
,
где множитель i учитывает процессы возможного распада (диссоциации) молекул в растворе. Для растворов неэлектролитов i=1, при диссоциации молекул электролитов на ионы i > 1, при ассоциации i < 1.
Растворы с одинаковыми осмотическими давлениями называют изотоническими. Физиологические растворы должны быть изотоническими относительно внутренних жидкостей организма - в противном случае происходит либо обезвоживание, либо пересыщение организма водой.
Если один раствор по сравнению с другим имеет более высокое осмотическое давление, его называют гипертоническим, а имеющий меньшее давление - гипотоническим.
Осмотическое давление крови человека составляет7,6 105 - 7,8 105 Па. Такое же осмотическое давление имеет физиологический раствор, т.е. 0,86% растворNaCl. Для сравнения нормальное атмосферное давление равно 105 Па. Осмотическое давление в клетках с/х животных составляет (6,8 -7,3)105 Па, и оно создает так называемый тургор клетки, придает ей определенную форму.
Основная часть осмотического давления обусловлена растворенными в плазме крови или в цитоплазме солями, но часть его определяется содержащимися в них белками (альбумин, глобулин и др.) и называется онкотическим давлением. Несмотря на его малую величину, оно играет важную роль в распределении воды между тканями и кровью.
Если клетка организма граничит с концентрированным водным раствором вещества, для которого мембрана клетки непроницаема, то вода переходит из клетки в этот раствор. Происходит осмотическое высасывание воды из клетки. Им, в частности, обусловлено чувство жажды, возникающее при приеме сладкой пищи.
|
|
|
В крови позвоночных животных находится специальный белок - сывороточный альбумин, который поддерживает постоянное осмотическое давление в кровеносной системе. Шок при сильных кровотечениях обусловлен не столько потерей крови, сколько резким падением осмотического давления, ведущим к клеточному коллапсу. Поэтому при больших потерях крови необходимо ввести заменители крови, благодаря которым восстанавливается осмотическое давление.
|
|
|


