 |
История открытия биопотенциалов. Гипотеза Бернштейна.
|
|
|
|
Одим из первых шагов на пути выяснения природы электрических явлений в живых организмах («животного электричества») был сделан тогда, когда французский священник аббат Нолле в 1746 году открыл явление осмоса. В то далекое время явление осмоса рассматривалось как результат действия неких особых, так называемых «жизненных» сил, которые действуют только в живых организмах[2]. В 1826 году французский врач и физиолог А. Дютроше заинтересовался явлением осмоса. Он был первым исследователем, кто научно доказал, что осмос есть результат проявления не особых, мифических «жизненных» сил, а законов физики и химии. С этого момента сторонники физико-химического подхода в биологии начали многочисленные исследования проявления осмоса в живых организмах. Осмосом начали объяснять работу почек, всасывание пищи в кишечнике.
В исследовании осмоса главную роль сыграли ботаники – они были первыми, кто начал изучать живые организмы, как теперь говорят, на клеточном уровне. Немецкий ботаник Пфеффер сделал важный и принципиальный шаг в исследовании осмоса – изобрел осмометр и измерил величину осмотического давления. Измеряя величину осмотического давления для разных растворов, Пфеффер обнаружил, что для каждого раствора величина давления прямо пропорциональна концентрации растворенного в растворителе вещества, не проходящего через полупроницаемую мембрану ( ~
~  , где m – масса растворенного вещества, V – объем раствора). Однако исследователь не смог объяснить, почему для разных растворов при одной и той же массовой концентрации получаются разные давления.
, где m – масса растворенного вещества, V – объем раствора). Однако исследователь не смог объяснить, почему для разных растворов при одной и той же массовой концентрации получаются разные давления.
В 70-х года XIX века голландский ботаник Х. Де Фриз [3] занимался явлением осмоса – изучал влияние осмоса на изменение объема клеток растений в растворах разной концентрации. Х. Де Фриз рассказал о работах Пфеффера по исследованию осмоса молодому голландскому химику Я. Вант-Гоффу. Изучив экспериментальный материал Пфеффера, Вант-Гофф пришел к заключению, что молекулы растворенного вещества в растворителе ведут себе подобно молекулам идеального газа. Следовательно, величину осмотического давления можно рассчитать по формуле для определения давления идеального газа:
|
|
|

где Cm – молярная плотность растворенного вещества. За теорию растворов Вант-Гофф через 15 лет получит Нобелевскую премию по химии.
Теория Вант-Гоффа давала точные значения величины осмотического давления для растворов многих веществ (сахароза, СО2). Но для некоторых веществ величина осмотического давления оказывалась больше расчетной в 2 раза. Вряд ли такую высокую погрешность (100%) можно объяснить неточностью измерений. Обдумывание данной проблемы привело к важнейшему открытию. Единомышленник Вант-Гоффа шведский ученый С. Аррениус предположил, что если, например, для раствора NaCl давление оказывается в два раза больше расчетного, то это может означать лишь одно – в растворе число частиц увеличивается вдвое. Увеличение вдвое числа части в растворе натолкнуло на мысль, что в растворе молекула поваренной соли распадается на две частицы. Из сопоставления этого факта с другими (например, сравнивая электропроводность раствора) Аррениус пришел к идее электролитической диссоциации. До Аррениуса считалось, что ионы в растворах возникают при действии на раствор электрического тока. Однако участие ионов в явлении осмоса показало, что это не соответствует действительности – ионы существуют в растворах некоторых веществ до пропускания через них электрического тока. Таким образом, изучение осмоса привело к открытию двух объектов, имеющих самое непосредственное отношение к «животному электричеству» - полупроницаемых мембран и ионов.
|
|
|
В 1887 году в первом номере «Журнала физической химии»[4] была опубликована статья Вант-Гоффа и Аррениуса с изложением теории электролитической диссоциации. Статья в журнале возвещала научному миру о новом подходе в химии. В Берлине в 1887 году окончил университет Вальтер Нернст (23 года). Впоследствии он станет знаменитым физиком и химиком, откроет третье начало термодинамики, получит Нобелевскую премию по химии, сменит на посту Института физики в Берлине знаменитого Макса Планка.
По окончании университета В. Нернст работал в должности ассистента Оствальда и темой своей диссертации он выбрал теоретическую работу о гальванических элементах. Теорией гальванических элементов до Нернста занимались такие великие ученые, как У. Томсон, Гиббс, Гельмгольц. Но Нернст решил разработать новую теорию гальванических элементов, исходя из того, что в электролитах существуют ионы, способные к диффузии. В 1889 году диссертация была завершена Нернстом и опубликована. В ней, в частности, была высказана и обоснована идея так называемого диффузионного потенциала, возникающего при соприкосновении двух жидкостей.
Кратко рассмотрим механизм возникновения диффузионного потенциала. Пусть имеется сосуд с непроницаемой перегородкой. По обе стороны перегородки в сосуде находится электролит различной концентрации. Пусть, например, концентрация электролита слева от перегородки будет больше, чем в правой части сосуда (см. рис. 20.1). После того как из сосуда будет изъята перегородка, в сосуде начнется процесс диффузии, стремящийся выровнять концентрации ионов электролита в левой и правой частях сосуда. А так как концентрация электролита в левой части изначально более высокая, то преобладающими будут потоки ионов из левой части сосуда в правую. Если предположить, что скорость движения положительных и отрицательных ионов разная (разная подвижность ионов), то более быстрые ионы (например, отрицательные) убегут вперед от более медленных ионов положительных ионов. Возникнет расслаивание катионов и анионов в растворе, вследствие чего в растворе образуется электрическое поле с разностью потенциалов, получившей название диффузионного потенциала. Величина диффузионного потенциала, согласно Нернсту, может быть рассчитана по формуле:
|
|
|
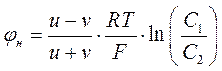 ,
,
где u и v – скорости более быстрого и более медленного ионов, R – универсальная газовая постоянная, T – температура раствора, F – постоянная Фарадея, C1 и C2 – концентрации электролита в левой и правой частях сосуда.

Таким образом, для возникновения диффузионного потенциала необходимыми условиями являются: а) разность концентраций электролита, различная подвижность анионов и катионов.
В 1890 году Вильгельм Оствальд, продолжая исследования полупроницаемых искусственных пленок, установил, что полупроницаемость пленок может вызвать не только осмос, но и электрические явления. Осмос возникает тогда, когда пленка пропускает относительно мелкие молекулы растворителя (например, воды), но не пропускает крупные молекулы растворенного вещества. Но ведь в электролите ионы могут иметь разные размеры. Если взять сосуд, разделить полупроницаемой пленкой на две части, в левую и правую части сосуда залить электролит разной концентрации, и если размеры пор в пленке позволяют проникать через нее только относительно мелким ионам, например, отрицательным ионам (см. рис. 20.2), то вследствие диффузии между левой и правой половинами сосуда возникнет разность потенциалов. Величина разности потенциалов определяется из формулы В.Нернста (если предположить, что скорость одного сорта ионов равна нулю – мембрана не пропускает данный сорт ионов):
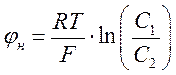

Таким образом, В. Оствальд объединил знания о полупроницаемых мембранах с формулой Нернста. Он предположил, что свойствами полупроницаемой мембраны можно объяснить потенциалы мышц, нервов, электрических органов рыб. Идея Оствальда, как ни странно, оказалась незамеченной ни биологами, ни физиологами. И только Юлиус Бернштейн смог ее оценить.
Бернштейн не только оценил идею Оствальда, но и сделал следующий решающий шаг на пути выяснения природы электричества в живых организмах. Он начал объяснять электрические свойства мышц и нервов не устройством этих органов в целом, а свойствами клеток, из которых эти органы состояли. Бернштейн был первым, кто указал на непосредственного «виновника» «животного электричества» - клеточную мембрану и перенос ионов.
|
|
|
Первые публикации Ю. Бернштейна по мембранной теории потенциалов появились в далеком 1902 году.1902 год по праву считается годом рождения мембранной теории биопотенциалов.
Согласно гипотезе Бернштейна, каждая клетка имеет оболочку, которая представляет собой полупроницаемую мембрану. Внутри и вне клетки имеются много свободных ионов, среди которых находятся ионы К+. Пусть концентрация ионов К+ внутри больше, чем вне клетки, и клеточная мембрана пропускает только ионы К+. Тогда ионы К+ начнут выходить из клетки, где их много, наружу. Одновременно с этим существует поток ионов К+ снаружи клетки внутрь, но так как снаружи ионов К+ мало, то и поток этот будет незначительный на фоне потока ионов К+, направленного изнутри клетки наружу. Вместе с ионами К+ наружу будет выноситься и положительный заряд. Поэтому на внутренней стороне мембраны клетки, находящейся в состоянии покоя, образуется скомпенсированный отрицательный электрический заряд, а на наружной стороне – положительный. Возникающая разность потенциалов будет тормозить вынос ионов К+ из клетки и увеличивать поток ионов К+ снаружи клетки внутрь клетки. Когда потоки ионов внутрь клетки и наружу сравняются, установится на клетке динамическое равновесие и на клеточной мембране будет поддерживаться постоянным по величине потенциал покоя. Разность потенциалов между внутренней стороной БМ и ее наружной стороной называется потенциалом покоя (ПП). Величина ПП описывается формулой Нернста:
 ,
,
где  - концентрация ионов калия внутри клетки,
- концентрация ионов калия внутри клетки,  - концентрация ионов калия снаружи клетки.
- концентрация ионов калия снаружи клетки.
Гипотеза Бернштейна о генерации ПП на клеточной мембране была встречена в научном мире без особого восторга и оваций. В глазах современников она выглядела не более чем гипотезой и самому Бернштейну, а затем и его последователям, понадобились годы и десятилетия упорного труда, споров и сомнений, пока удалось доказать свою правоту. В первую очередь гипотеза требовала экспериментальных подтверждений. Бернштейну пришлось придумать серию научных экспериментов, которые могли бы, пусть даже и косвенно, подтвердить его теорию.
Таким образом, за открытием природы электрических явлений в живых организмах видится многолетний труд ученых разных направлений:
- ботаников – измеривших осмотическое давление;
- физиков – открывших электрические заряды и электрические и газовые законы;
- химиков – создавших теории растворов и электролитической диссоциации;
- математиков – труды, которых позволили создать дифференциальное и интегральное исчисление.
|
|
|
|
|
|


