 |
Изучение адсорбции уксусной кислоты на твёрдом адсорбенте
|
|
|
|
Цель работы. Целью работы является изучение адсорбции на твёрдом адсорбенте уксусной кислоты изводногораствора, построение изотермыадсорбции и расчет констант уравнения адсорбции Лэнгмюра.
Краткая теоретическая часть
Адсорбция из растворов на твёрдом адсорбенте описывается уравнением Лэнгмюра, имеющим вид:
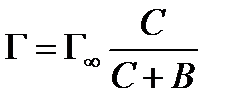 , (8.1)
, (8.1)
где Г – количество вещества, адсорбированного 1 г адсорбента;
С – концентрация раствора после достижения адсорбционного равновесия;
Г∞– предельная адсорбция, соответствующая состоянию, когда все активные центры твердого адсорбента заняты молекулами адсорбируемого вещества;
В – константа, характеризующая межмолекулярные взаимодействия между твёрдым адсорбентом и молекулами адсорбируемого вещества (адсорбата).
Г∞ и В зависят от природы адсорбента и адсорбируемого вещества,
а В зависит также от температуры.
Ход работы
В качестве адсорбента используют активированный уголь; в качестве
адсорбата – уксусную кислоту.
Берут 2 N уксусную кислоту и готовят в шести колбах следующие растворы кислоты различной концентрации:
| № колбы | V раствора, см 3 | Нормальность раствора |
| 0,012 | ||
| 2 | 0,025 | |
| 0,05 | ||
| 0,10 | ||
| 0,20 | ||
| 0,40 |
Для вычисления объема 2 N уксусной кислоты в см 3 (мл), который надо добавить в каждую из шести колб, используют следующее соотношение:
N 1 V 1= N 2 V 2, (8.2)
где N 1 – нормальность исходного раствора кислоты (в нашем случае N 1=2);
N 2 – нормальность получаемого раствора кислоты (например, для колбы №1 N 2=0,012);
V 2– количество см 3 (мл) раствора получаемой кислоты (т.е. для колбы №1 V 2=150);
V 1 - количество см 3 (мл) исходного 2 N раствора кислоты.
|
|
|
Точное содержание уксусной кислоты определяют титрованием полученных растворов 0,1 N раствором NaOH в присутствии фенолфталеина, причём для титрования из колбы №1, №2 и №3 отбирают пипеткой по 50 см 3 раствора, из колбы №4 – 25 см 3, из колбы №5 – 10 см 3, из колбы №6 – 5 см 3.
Таким образом, во всех шести колбах остаётся по 100 см 3 раствора уксусной кислоты.
Затем в каждую колбочку добавляют по 0,5 г активированного угля (адсорбента), оставляют стоять 10 мин до установления адсорбционного равновесия, взбалтывая по очереди содержимое каждой колбы.
Растворы фильтруют и фильтраты оттитровывают 0,1 N раствором NaOH, отобрав те же объёмы, как и при титровании исходных растворов кислоты.
Для того, чтобы рассчитать начальную (C 0) и равновесную (С) концентрацию уксусной кислоты в каждой колбе, необходимо количество см 3 NaOH, пошедших на титрование, умножить на следующие величины:
| № колбы | Множитель |
т.к. для титрования берут различные объёмы, а расчет ведут на 100 см 3 раствора.
Величину адсорбции Г вычисляют, как разность (C 0 – С). Полученные значения C 0, С, Г, С /Г заносят в таблицу 8.1.
Таблица 8.1 – Результаты измерения адсорбции CH3COOH на угле
| № колбы | С 0 начальная концентрация уксусной кислоты, выраженная в см 3 0,1 N раствора NaOH на 100 см 3 раствора кислоты | С равновесная концентрация уксусной кислоты, выраженная в см 3 0,1 N раствора NaOH на 100 см 3 фильтрата | Г= С 0 – С (количество адсорбированной уксусной, кислоты, выраженное в см 3 0,1 N раствора NaOH на 100 см 3 раствора кислоты) | С / Г |
Обработка результатов
Уравнение адсорбции Лэнгмюра после алгебраических преобразований принимает вид
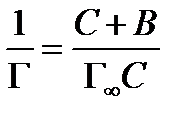 или
или 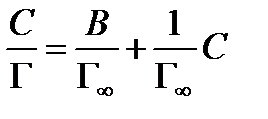 (8.3)
(8.3)
|
|
|
Тангенс угла наклона прямой линии на рисунке 8.1 дает значение 1/Г∞, а отрезок, отсекаемый прямой на оси С /Г равен B /Г∞. По найденным из графика значениям 1/Г∞ и B /Г∞ рассчитывают константы уравнения Лэнгмюра Г∞ и B.
Задавая ряд произвольных значений равновесных концентраций C (в пределах концентраций исследуемых растворов) по уравнению (8.1) рассчитывают теоретические значения адсорбции.
Используя найденные значения констант Г∞, B и полученные данные строят изотерму адсорбции, т.е. зависимость величины адсорбции Г от равновесной концентрации раствора С. На полученный график также наносят опытные значения адсорбции Г при соответствующих концентрациях C, используя данные таблицы 8.1.
Примечание.
В качестве адсорбата можно взять щавелевую кислоту. В этом случае используют 0,2 N раствор щавелевой кислоты и готовят в шести колбах следующие растворы кислоты различной концентрации:
| № колбы | V раствора, см 3 | Нормальность раствора |
| 150 | 0,0030 | |
| 150 | 0,0050 | |
| 150 | 0,0075 | |
| 125 | 0,0100 | |
| 0,0150 | ||
| 105 | 0,0200 |
Адсорбент – активированный уголь в количестве 0,2 г. Время адсорбции (установление адсорбционного равновесия) –5 мин.
Титрование проводят 0,05 N раствором NaOH.
9 НАБУХАНИЕ ПОЛИМЕРОВ
Взаимодействие полимеров с растворителем имеет большое значение при переработке полимеров, а также при их взаимодействии в различных процессах, в том числе биологических. Например, белки и полисахариды в живых организмах и растениях находятся в набухшем состоянии. Многие синтетические волокна и пленки получают из растворов полимеров. Растворами полимеров являются лаки и клеи. Определение свойств макромолекул, в том числе молекулярной массы полимеров, проводят, как правило, в растворах. Пластификация полимеров, осуществляемая при производстве изделий, основана на набухании полимеров в растворителях – пластификаторах.
Для практического применения полимеров важным свойством является их устойчивость по отношению к растворителям. Для решения вопросов о возможном набухании, растворении полимера в данном растворителе или об его устойчивости по отношению к этим процессам необходимо изучение закономерностей взаимодействия полимеров с различными растворителями.
|
|
|
Набуханием называется процесс самопроизвольного поглощения жидкости полимером, сопровождающийся значительным увеличением его объема. Этот процесс характерен для многих высокомолекулярных соединений, например, каучука, желатина, агар-агара, поливинилового спирта, полиакриламида, пектиновых веществ и многих др. На начальном этапе набухания полимер переходит в гель – дисперсную систему, состоящую, как минимум, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, а другой – низкомолекулярный растворитель – он заполняет пустоты между элементами каркаса и представляет собой дисперсионную среду.
Если в результате набухания гель переходит в раствор, набухание называется неограниченным, если набухающее тело поглощает жидкость до определенного предела, оставаясь к концу процесса набухания в состоянии геля – ограниченным.
Ограниченное набухание в некоторых случаях может переходить в неограниченное. Например, если желатин, набухший в воде при температуре ниже 22°С, нагреть, то он начинает растворяться с образованием истинного раствора.
Ограниченное набухание характерно для сшитых полимеров, имеющих поперечные межмолекулярные связи, в то время как несшитые (линейные) полимеры в подходящих растворителях набухают неограниченно. В состоянии ограниченного набухания система состоит из двух фаз, находящихся в равновесии: насыщенного раствора низкомолекулярного растворителя в полимере, т.е. геля, и насыщенного раствора полимера в растворителе, как правило, небольшой концентрации. Такое двухфазное равновесие аналогично равновесию при ограниченном растворении низкомолекулярных веществ.
Набухание – явление избирательное, т.е. данный полимер может набухать только в определенных жидкостях, близких ему по полярности. Например, желатин хорошо набухает в воде, но не набухает в толуоле, тогда как каучук не набухает в воде и хорошо набухает в различных углеводородах, например, в бензоле, толуоле и др.
|
|
|
Процесс набухания состоит в поглощении растворителя полимером, при этом объем и масса полимера увеличиваются. Набухание наиболее характерно для высокомолекулярных соединений. В результате набухания их объём и масса могут увеличиваться в 10¸15 раз.
Неорганические материалы, обладающие жесткой структурой, мало способны к набуханию. Они могут удерживать жидкости в порах в основном вследствие адсорбции и капиллярных явлений, при этом их структура, а, следовательно, и объём не изменяются. Однако, такие неорганические соединения, как диоксид кремния, оксид алюминия, а также глины, частицы которых не связаны между собой, набухают в воде с образованием соответствующих гелей.
Низкомолекулярной дисперсионной средой в гелях может служить не только вода, но и низшие моно- и олигоспирты, углеводороды. Гели с водной дисперсионной средой называются гидрогелями, со спиртовой – алкогелями, с углеводородной – органогелями (общее название гелей с различными дисперсионными средами – лиогели).
Масса жидкости, поглощенная единицей массы полимера при данной температуре, называется степенью набухания:
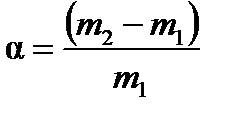 , (9.1)
, (9.1)
где т 1и т 2– масса вещества до и после набухания, соответственно.
Зависимость степени набухания от термодинамической активности растворителя (от давления его паров) при постоянной температуре называется изотермой набухания. Типичные изотермы набухания представлены на рисунке 9.1, из которых видно, что степень набухания увеличивается с ростом давления паров растворителя.
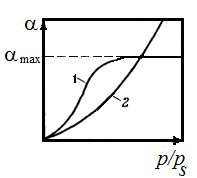 Рисунок 9.1 – Изотермы ограниченного (1) и неограниченного (2)набухания: р и ps – давление насыщенного парарастворителя соответственно над набухшим полимером и над чистым растворителем
Рисунок 9.1 – Изотермы ограниченного (1) и неограниченного (2)набухания: р и ps – давление насыщенного парарастворителя соответственно над набухшим полимером и над чистым растворителем
|
Набухание – осмотический процесс, при котором происходит диффузия молекул растворителя в объём полимера. Такой односторонний процесс объясняется тем, что макромолекулы полимера имеют большие размеры, благодаря чему они переплетены между собой и слабо подвержены действию теплового движения. В противоположность молекулам полимера небольшие молекулы растворителя очень подвижны, они легко проникают в поры высокомолекулярного соединения, увеличивая его объем.
|
|
|
 Рисунок 9.2 – Кинетические кривые ограниченного (1) и неограниченного (2) набухания
Рисунок 9.2 – Кинетические кривые ограниченного (1) и неограниченного (2) набухания
|
Кинетические кривые набухания, характеризующие зависимость степени набухания от времени при постоянстве активности растворителя (давлении пара), представлены на рисунке 9.2. При неограниченном набухании в определенный момент времени растворение приводит к уменьшению массы образца.
Максимальная степень набухания (предельное набухание) 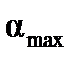 и время ее достижения
и время ее достижения 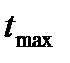 , определяющие способность полимера поглощать низкомолекулярную жидкость при данной температуре, являются важными характеристиками ограниченного набухания. Чем больше молекулярная масса полимера, тем медленнее происходит процесс набухания, т.е. тем больше
, определяющие способность полимера поглощать низкомолекулярную жидкость при данной температуре, являются важными характеристиками ограниченного набухания. Чем больше молекулярная масса полимера, тем медленнее происходит процесс набухания, т.е. тем больше 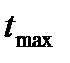 .
.
Уравнение, описывающее кинетику ограниченного набухания можно представить в виде дифференциального уравнения первого порядка:
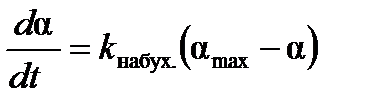 , (9.2)
, (9.2)
где k набух.– константа скорости набухания; amax и a– степень набухания при достижении равновесия и к моменту времени t, соответственно.
В результате интегрирования в пределах от a=0 до a=a t получим уравнение кинетики набухания:
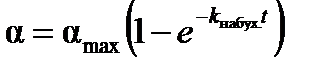 . (9.3)
. (9.3)
Скорость набухания в данный момент времени определяется тангенсом угла наклона касательной к кинетической кривой набухания в соответствующей точке. С ростом степени набухания скорость набухания уменьшается.
При набухании полимеров часто наблюдается такое явление как контракция, т.е. уменьшение общего объема системы полимер/растворитель. Контракция происходит на первой начальной стадии набухания и объясняется взаимодействием полимера с растворителем (сольватацией), при котором происходит уплотнение системы. В начальный момент набухания молекулы растворителя, проникая в полимер, образуют первичные сольватные слои. Так, при набухании полярных полимеров, например, желатина, полиакриламида и др., в воде входящую в первичный гидратный слой воду называют «связанной» водой в отличие от «свободной», которая поглощается после формирования первичного гидратного слоя. В результате при малых степенях набухания наблюдается как наибольшее уменьшение общего объема системы – контракция, так и выделение теплоты набухания. Из-за выделения теплоты нагревание системы полимер/растворитель на начальной стадии набухания приводит к замедлению процесса (принцип Ле-Шателье).
Вторая стадия набухания протекает практически без выделения теплоты набухания (внутренняя энергия системы остается постоянной) и контракции системы. Нагревание системы на этой стадии ускоряет набухание, а при неограниченном набухании – и последующее растворение полимера. Вторая стадия набухания обычно отличается от первой значительно бóльшим поглощением низкомолекулярного растворителя. Например, желатин поглощает гидратной («связанной») воды около 50 % масс. (первая стадия), а общее количество воды, которое она может поглотить составляет около 2000 % масс. (в расчете на ее массу). Вторая стадия набухания характеризуется энтропийным эффектом: энтропия растет вследствие перехода в раствор отдельных макромолекул, ослабления связей между ними и увеличения числа их возможных конформаций.
Лабораторная работа № 9
|
|
|


