 |
Кислородные соединения азота. Общая характеристика его оксидов. Азотистая кислота и нитриты. Их физиологическая активность.
|
|
|
|
Азот образует шесть кислородных соединений, в которых проявляет степени окисления от +1 до +5: N2О, NO, N2O3, NO2, N2O4, N2O5. При непосредственном соединении азота с кислородом образуется только оксид азота (II) NO, другие оксиды получают косвенным путем. N2О и NO — несолеобразующие оксиды, остальные — солеобразующие. Из всех оксидов азота наибольшее значение имеют оксиды азота (II) и азота (IV) как промежуточные продукты в производстве азотной кислоты.
Оксид азота (II) NO — бесцветный газ, плохо растворимый в воде (его можно собирать в цилиндре над водой). Оксид азота (II) обладает замечательным свойством: непосредственно соединяется с кислородом воздуха, образуя бурый газ — оксид азота (IV):
2NO + O2 = 2NO2
В лабораторных условиях оксид азота (II) получают при взаимодействии разбавленной азотной кислоты и меди:
3Сu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота (II) получают также окислением аммиака кислородом воздуха в присутствии катализатора платины. Он постоянно образуется в воздухе во время грозы под действием электрических зарядов.
Оксид азота (IV) NO2 — газ бурого цвета со специфическим запахом, тяжелее воздуха, ядовит, раздражает дыхательные пути. В лабораторных условиях NO2 получают при взаимодействии концентрированной азотной кислоты и меди:
Cu + 4HNO3 = Cu (NO3)2 + 2NO2 + 2H2O
Оксид азота (IV) подвергается димеризации, образуя бесцветную жидкость – димер оксида азота (IV):
2NO2 = N2O4
При взаимодействие с водой NO2 образует азотную кислоту:
3NO2 + H2O = 2HNO3 + NO
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
|
|
|
Вопрос№50.
Свойства и методы получения азотной кислоты. Взаимодействие азотной кислоты с металлами и неметаллами. Азотные удобрения – селитры.
Получение.
В лабораторных условиях азотная кислота получается из ее солей действием концентрированной серной кислоты:
KNO3 + H2SO4 = HNO3 + KHSO4
Реакция протекает при слабом нагревании (сильное нагревание разлагает НNОз).
В промышленности азотная кислота получается каталитическим окислением аммиака, который, в свою очередь, образуется как соединения водорода и азота воздуха. Весь процесс получения азотной кислоты можно разбить на три этапа:
1. Окисление аммиака на платиновом катализаторе до NO:
4NH3 + 5O2 = 4NO + 6H2O
2. Окисление кислородом воздуха NO до NO2:
2NO + O2 = 2NO2
3. Поглощение NO2 водой в присутствии избытка кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Физические свойства.
Азотная кислота — бесцветная жидкость с едким запахом. Очень гигроскопична, «дымит» на воздухе, так как пары ее с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. Кипит при 86 °С.
Химические свойства.
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3

Разбавленная HNO3
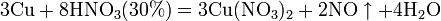
б) с металлами, стоящими в ряду напряжений левее водорода:
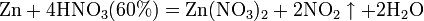
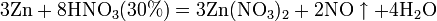


4Zn + 10HNO3(3%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
в) с неметаллами:

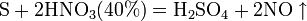


Сели́тры — общее тривиальное название минералов, содержащих нитраты различных металлов (в том числе их кристаллогидратов).
Применение селитр.
Селитры используются как азотные удобрения, при этом калиевая селитра является также источником необходимого растениям калия. Нитрат калия также является одним из ингредиентов чёрного пороха. Аммонийная селитра используется для приготовления таких взрывчатых веществ как аммонал и аммотол. К аммиачным удобрениям относятся: сульфат аммония, хлористый аммоний, бикарбонат аммония, жидкие азотные удобрения.
|
|
|
Вопрос№51.
|
|
|


