 |
Тема 5. Растворы электролитов
|
|
|
|
Задание 1. Ионная сила раствора
Вычислите ионную силу I раствора и активность ионов ai в растворе, содержащем два сильных электролита заданных молярных концентраций св. Плотность раствора принять равной 1 г/мл.
| Номер варианта | Электролит 1 | с 1, моль/л | Электролит 2 | с 2, моль/л |
| KNO3 | 0,005 | K2SO4 | 0,001 | |
| KNO3 | 0,004 | Ca(NO3)2 | 0,002 | |
| NaCl | 0,003 | ZnCl2 | 0,003 | |
| Pb(NO3)2 | 0,002 | Pb(CH3COO)2 | 0,004 | |
| FeCl3 | 0,001 | MgCl2 | 0.005 | |
| BaCl2 | 0,001 | Ba(NO3)2 | 0,004 | |
| Na2SO4 | 0,002 | ZnSO4 | 0,003 | |
| ВаCl2 | 0,003 | AlCl3 | 0,001 | |
| NH4Cl | 0,004 | (NH4)2SO4 | 0,005 | |
| MgSO4 | 0,005 | Al2(SO4)3 | 0,002 |
Задание 2. Растворы слабых электролитов
Для раствора слабого электролита:
а) напишите уравнения процесса диссоциации по всем возможным ступеням, выражения для констант диссоциации для каждой ступени и укажите их величину, используя данные таблицы в приложении 5;
б) рассчитайте степень диссоциации и рН для заданной концентрации раствора слабого электролита, подберите индикатор;
в) вычислите, как изменится рН раствора слабого электролита заданной концентрации, к 1 л которого добавили соль массой m. Степень диссоциации сильного электролита принять равной 1.
| Номер варианта | Исходный раствор | Соль | ||
| Слабый электролит | св, моль/л | Сильный электролит | m, г | |
| H2S | 10–3 | Na2S | 7,8 | |
| Cd(OH)2 | 10–5 | CdCl2 | 1,8 | |
| CH3COOH | 10–1 | CH3COOK | 9,8 | |
| NH4OH | 10–1 | NH4Cl | 5,3 | |
| HBrO | 10–2 | NaBrO | 1,2 | |
| Co(OH)2 | 10–6 | CoCl2 | 1,7 | |
| HNO2 | 10–2 | NaNO2 | 6,9 | |
| Mg(OH)2 | 10–4 | MgCl2 | 1,0 | |
| HCN | 10–3 | KCN | 6,5 | |
| Mn(OH)2 | 10–5 | MnCl2 | 1,3 |
Задание 3. Произведение растворимости
Для малорастворимого электролита:
а) напишите уравнение фазового равновесия в его насыщенном растворе; для константы этого равновесия приведите название, выражение (по закону действующих масс) и значение, используя данные таблицы в приложении;
|
|
|
б) определите, можно ли приготовить раствор данного электролита указанной концентрации с 1 и рассчитайте, в каком объеме воды при комнатной температуре можно растворить 0,5 г данного вещества;
в) определите, как изменится его растворимость в растворе заданного электролита с указанной концентрацией с 2 по сравнению с чистой водой. (Расчет провести приближенно, без учета коэффициентов активности сильного электролита.)
| Номер варианта | Малорастворимый электролит | с 1, моль/л | Раствор электролита | с 2, моль/л |
| BaSO4 | 5×10–6 | Na2SO4 | 1×10–1 | |
| Co(OH)2 | 1×10–4 | NaOH | 1×10–2 | |
| Ag2CrO4 | 2×10–3 | AgNO3 | 1×10–4 | |
| Ca3(PO4)2 | 1×10–6 | Na3PO4 | 2×10–3 | |
| Sr(OH)2 | 5×10–2 | SrCl2 | 5×10–1 | |
| CaF2 | 2×10–4 | CaCl2 | 5×10–2 | |
| MnCO3 | 1×10–5 | Na2CO3 | 1×10–3 | |
| CdS | 1×10–7 | Na2S | 1×10–5 | |
| Mg(OH)2 | 2×10–4 | MgCl2 | 4×10–5 | |
| SnI2 | 5×10–3 | NaI | 1×10–4 |
Задание 4. Гидролиз солей
Укажите, какие из приведенных ниже солей подвергаются гидролизу, напишите для них молекулярные и ионно-молекулярные уравнения гидролиза по всем возможным ступеням и выражения для констант гидролиза. Укажите реакцию среды.
| Номер варианта | Соли | Номер варианта | Соли |
| MnCl2, (NH4)2CO3, NаHCO3, Sr(NO3)2 | NaClO4, CoSO4, KCN, NH4F | ||
| Rb2S, KNO3, Fe2(SO4)3, Na2HPO4 | RbH2PO4, K2SO4, Na2Se, Zn(NO3)2 | ||
| NaHS, Li2SO3, Cs2SO4, Bi(NO3)3 | NaHSO3, CaClO2, MnF2, KMnO4 | ||
| BaS, Cr(NO3)3, (NH4)2S, CaCl2 | KHSe, NH4NO2, MnSO4, Sr(CN)2 | ||
| NH4NO3, Na3PO4, Mg(CH3COO)2, K2SO4 | Na3AsO4, CoSO4, CaSO4, Cu(CH3COO)2 |
Задание 5. Константа и степень гидролиза
Для указанных водных растворов солей заданной концентрации св вычислите константу гидролиза К Г, степень гидролиза b и значение рН раствора, учитывая только первую ступень гидролиза. Подберите индикатор. Какую соль надо добавить в данный раствор, чтобы усилить гидролиз?
| Номер варианта | Соль | с, моль/л | Номер варианта | Соль | с, моль/л |
| Pb(NO3)2 | 0,1 | FeCl2 | 0,01 | ||
| K2SO3 | 0,1 | KF | 0,001 | ||
| Na2CO3 | 0,01 | AlI3 | 0,01 | ||
| Na3PO4 | 0,001 | CH3COONa | 0,1 | ||
| ZnSO4 | 0,1 | CuBr2 | 0,001 |
|
|
|
Тема 6. Коллигативные свойства растворов
неэлектролитов и электролитов
Пример 1. При 25 °С давление насыщенного пара воды составляет 3,166 кПа (23,75 мм. рт.ст.). Определите при той же температуре давление насыщенного пара над 5 %-м водным раствором карбамида CO(NH2)2.
Решение
Для идеальных растворов при постоянной температуре в состоянии равновесия между раствором и газовой фазой над ним давление насыщенного пара каждого компонент рi выражается уравнением:
pi =  ,
,
где Ni – мольная доля компонента,  – давление пара чистого компонента.
– давление пара чистого компонента.
Вычислим мольную долю растворителя Ni по формуле
 ,
,
где n 1и n 2 – число молей растворителя и растворенного вещества соответственно.
В 100 г раствора содержится 5 г карбамида (мольная масса 60 г/моль) и 95 г воды (мольная масса 18 г/моль). Количество карбамида и воды соответственно равно:
n 1 =  = 5,278 моль; n 2 =
= 5,278 моль; n 2 = 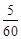 = 0,083 моль.
= 0,083 моль.
Находим мольную долю растворителя (воды):
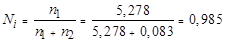 .
.
Следовательно,
pi =  = 0,985×3,166 = 3,119 кПа (или 23,31 мм рт. ст.).
= 0,985×3,166 = 3,119 кПа (или 23,31 мм рт. ст.).
Пример 2. Рассчитайте, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы C6H12O6.
Решение
Понижение температуры замерзания растворителя (воды) выражается уравнением
∆ Т крист = K кр× сm,
где K кр – криоскопическая постоянная данного растворителя, сm – моляльность раствора.
Определим моляльность раствора (М(С6Н12О6) = 180 г/моль):
 моль/кг,
моль/кг,
∆ Т крист = K кр× сm = 1,86×1,2 = 2,23 °С.
Следовательно, раствор будет кристаллизоваться при –2,23 °С.
Пример 3. Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,86 °С, тогда как чистый эфир кипит при 35,60 °С. Определите молекулярную массу растворенного вещества.
Решение. Из условия задачи находим разность температур кипения:
∆ Т кип = 36,86 – 35,60 = 1,26°.
Повышение температуры кипения раствора определяется по уравнению
∆ Т кип = K эб× сm,
где K эб – эбуллиоскопическая постоянная растворителя.
Определяем моляльность раствора:
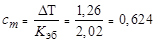 моль/1000 г эфира.
моль/1000 г эфира.
Молекулярную массу растворенного вещества найдем из соотношения
|
|
|
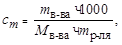
откуда
 г/моль.
г/моль.
Пример 4. Навеска вещества массой 12,42 г растворена в 500 см3 воды. Давление пара полученного раствора при 20 °С равно 3732,7 Па. Давление пара воды при той же температуре равно 3742 Па. Рассчитайте мольную массу растворенного вещества.
Решение. Пользуясь законом Рауля 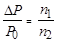 и учитывая условия задачи, получим:
и учитывая условия задачи, получим:
∆ P = 3742 – 3732,7 = 9,3 Па; n 2 = 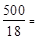 27,78 моль,
27,78 моль,
тогда число молей (n 1) растворенного вещества будет равно
 0,069 моль.
0,069 моль.
Поскольку 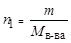 , то
, то  =
= 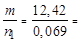 180 г/моль.
180 г/моль.
Пример 5. Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при –0,23 °С. Определите кажущуюся степень диссоциации ZnCl2.
Решение. Найдем моляльную концентрацию сm соли в растворе. Поскольку мольная масса ZnCl2 равна 136,3 г/моль, то
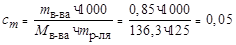 моль/кг.
моль/кг.
Определим понижение температуры кристаллизации без учета диссоциации электролита (K кр воды равна 1,86):
∆ Т крист.выч = K кр× сm = 1,86×0,050 = 0,093 °С.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, вычисляем изотонический коэффициент i:
i = ∆ Т крист/∆ Т крист.выч = 0,23/0,093 = 2,47.
Кажущуюся степень диссоциации aсоли найдем из соотношения
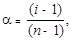
где n – общее число ионов (ZnCl2 ® Zn2+ + 2 Cl–)

Пример 6. При растворении гидроксида натрия массой 12 г в воде массой 100 г температура кипения повысилась на 2,65°. Определите степень диссоциации (%) гидрокcида натрия.
Решение. Для сильных электролитов имеем:
∆ Т кип. = i × K эб× сm.
Откуда
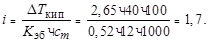
Тогда
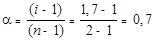 .
.
Пример 7. Определите осмотическое давление раствора сахарозы при 0 °С, если при 20 °С осмотическое давление этого же раствора равно 1,066×105 Па.
Решение. Осмотическое давление – это минимальное давление, которое нужно приложить к раствору, чтобы остановить осмос. Согласно закону Вант-Гоффа, осмотическое давление (кПа) равно
 ,
,
где с – молярная концентрация раствора, моль/л; R – молярная газовая постоянная 8,314 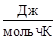 , Т – температура, К.
, Т – температура, К.
Определим концентрацию раствора сахарозы при известной температуре и осмотическом давлении:
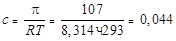 моль/л,
моль/л,
тогда осмотическое давление сахарозы при 0 °С составит
 = 0,044 × 8,314 × 273 = 99,7 кПа.
= 0,044 × 8,314 × 273 = 99,7 кПа.
|
|
|
Эбуллиоскопическая и криоскопическая константы зависят только от природы растворителя.
Значения этих констант для некоторых растворителей представлены в следующей таблице.
| Растворитель | Ккр, 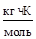
| Кэб, 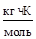
|
| Вода | 1,86 | 0,52 |
| Бензол | 5,10 | 2,57 |
| Этиловый эфир | 2,12 | – |
| Фенол | 7,3 | 3,60 |
| Этанол | 1,99 | 1,22 |
| Ацетон | – | 1,80 |
| Уксусная кислота | 3,9 | 3,1 |
| CCl4 | 2,98 | 5,3 |
|
|
|


