 |
Основные теоретические сведения
|
|
|
|
Основными величинами, которыми оперирует термодинамика, являются внутренняя энергия термодинамической системы U, теплота Q, переданная ей, и совершенная системой работа A.
Внутренняя энергия тела U представляет собой полную энергию беспорядочного движения молекул (поступательного, колебательного и вращательного).
При взаимодействии термодинамической системы с окружающими телами происходит обмен энергией. При этом возможны два различных способа передачи энергии от системы к внешним телам: с изменением внешних параметров системы и без изменения этих параметров. Первый способ передачи энергии называется работой, второй – теплотой.
Теплота, работа и внутренняя энергия связаны между собой соотношением:
 . (3.1)
. (3.1)
Соотношение (3.1) представляет собой I начало термодинамики: количество теплоты  , переданное системе, идёт на увеличение её
, переданное системе, идёт на увеличение её
внутренней энергии  и на работу
и на работу  , совершаемую силами, приложенными со стороны системы к внешним телам.
, совершаемую силами, приложенными со стороны системы к внешним телам.
Из определения внутренней энергии следует, что в любом состоянии системы она имеет определённое значение, которое не зависит от того, каким способом это состояние было получено. Внутренняя энергия  является функцией состояния термодинамической системы. Если система совершает круговой (циклический) процесс, то полное изменение её внутренней энергии
является функцией состояния термодинамической системы. Если система совершает круговой (циклический) процесс, то полное изменение её внутренней энергии  . Математически это означает, что подинтегральное выражение
. Математически это означает, что подинтегральное выражение 
 является полным дифференциалом некоторой функции.
является полным дифференциалом некоторой функции.
Работа  , совершаемая в круговом процессе, во всех случаях, когда имеет место нагревание, не равна нулю. Это означает, что работа A не является функцией состояния системы. Работа – это функция процесса. Следовательно, элементарная работа
, совершаемая в круговом процессе, во всех случаях, когда имеет место нагревание, не равна нулю. Это означает, что работа A не является функцией состояния системы. Работа – это функция процесса. Следовательно, элементарная работа  в (3.1) не представляет собой полного дифференциала. То же самое относится к количеству теплоты: в разных термодинамических процессах количество теплоты, которое требуется для нагревании системы от температуры T1 до температуры T2 различно. Количество теплоты не является функцией состоянии системы, а элементарная теплота
в (3.1) не представляет собой полного дифференциала. То же самое относится к количеству теплоты: в разных термодинамических процессах количество теплоты, которое требуется для нагревании системы от температуры T1 до температуры T2 различно. Количество теплоты не является функцией состоянии системы, а элементарная теплота  не является полным дифференциалом.
не является полным дифференциалом.
|
|
|
Опыт показывает, что две формы передачи энергии в форме теплоты и в форме работы не являются равноценными. При преобразовании работы в теплоту можно ограничиться только двумя телами, из которых одно передаёт при тепловом контакте энергию другому. При превращении теплоты в работу необходимо иметь по меньшей мере три тела: первое отдаёт энергию в форме теплоты (нагреватель), второе получает эту теплоту и отдаёт энергию в форме работы (рабочее тело) и третье тело, которому рабочее тело непременно отдаёт часть полученной от нагревателя теплоты (холодильник).
Такая неравноправность превращения теплоты в работу по сравнению с превращением работы в теплоту, связана с односторонностью естественных процессов.
Для рассмотрения этого свойства термодинамических процессов введём понятия квазистатического, обратимого и необратимого процессов.
Система находится в термодинамическом равновесии, если макроскопические величины, определяющие её состояние остаются постоянными и равными своим средним значениям. В случае идеального газа, например, такими макроскопическими величинами являются прежде всего давление и температура. В состоянии равновесия не могут происходить такие явления, как теплопроводность, диффузия, химические реакции, фазовые переходы.
Процессы, в ходе которых система всё время остаётся в состоянии равновесия, называются квазистатическими.
Если термодинамическая система по каким – либо причинам не находится в состоянии равновесия или выведена из него и после этого предоставлена самой себе, то, как показывает опыт, сам собой происходит переход к равновесному состоянию.
|
|
|
Процесс перехода к равновесию называется релаксацией, а время, требующееся на это, называется временем релаксации.
Реальный процесс можно считать квазистатическим, если скорость изменения какого – либо параметра системы (например, давления в газе) гораздо меньше средней скорости изменения этого параметра при релаксации.
Когда равновесие уже установилось, система не может сама собой возвратиться в первоначальное неравновесное состояние.
Так, например, если два соприкасающихся тела обладали в начале разностью температур и были предоставлены самим себе, то, в конце концов, температуры обоих тел выравниваются. Но обратный процесс – увеличение разности температур между ними – без внешнего воздействия не происходит.
Газ сам по себе всегда распределяется равномерно по всему объёму сосуда, и такое состояние соответствует равновесию. Но газ никогда не скапливается в одной части сосуда в большем количестве (с большей плотностью), чем в другой, без действия внешних сил.
Точно также, если ввести в сосуд два разных газа, то вследствие взаимной диффузии они сами собой перемешаются, так что состав смеси станет всюду одинаковым. Это и будет равновесным состоянием. Однако, чтобы разделить газы, требуется затратить большие усилия извне.
Приведённые примеры показывают, что естественные процессы идут в определённом направлении: от неравновесного состояния к равновесному. Эти процессы, происходящие в молекулярных системах, имеют важную особенность – они необратимы. Этим молекулярные процессы отличаются от чисто механических, для которых характерна строгая обратимость.
Обратимым процессом называется такое изменение состояния системы, которое, будучи проведено в обратном направлении, возвращает её в исходное состояние так, чтобы система прошла через те же промежуточные состояния, что и в прямом процессе, но в обратной последовательности, а состояние тел вне системы осталось неизменным.
Процессы, не удовлетворяющие этим условиям, являются необратимыми.
Все квазистатические процессы обратимы. Полностью необратимые процессы происходят часто. К числу таких процессов относятся расширение газа в пустоту, не уравновешенное внешними силами, теплопроводность, диффузия, внутреннее трение. Напротив, полностью необратимые процессы представляют собой идеальные предельные случаи реальных процессов. Все действительно происходящие процессы только частично обратимы; они всегда содержат необратимую часть.
|
|
|
Физическая величина, которая количественно характеризует направленность необратимых процессов и неравнозначность преобразования теплоты в работу и наоборот, называется энтропией.
Введём понятие энтропии на примере идеального газа. Разделим обе части равенства (3.1) на абсолютную температуру Т:
 . (3.2)
. (3.2)
В случае идеального газа
 , (3.3)
, (3.3)
где  – количество газа;
– количество газа;  – молярная теплоёмкость газа при постоянном объёме,
– молярная теплоёмкость газа при постоянном объёме,  – изменение его температуры.
– изменение его температуры.
Элементарная работа
 , (3.4)
, (3.4)
где р – давление; dV – изменение объёма газа.
Из уравнения Клапейрона- Менделеева:
 . (3.5)
. (3.5)
Подставляя (3.3)-(3.5) в уравнение (3.2), получим:
 . (3.6)
. (3.6)
Учитывая, что  и
и  , перепишем уравнение (6) в виде
, перепишем уравнение (6) в виде
 . (3.7)
. (3.7)
Правая часть этого равенства представляет собой полный дифференциал, следовательно, и левая часть  также есть полный
также есть полный
дифференциал некоторой функции S:
 . (3.8)
. (3.8)
Введенная таким образом функция S называется энтропией. Энтропия, также как и внутренняя энергия, является функцией состояния системы, поэтому
 (равенство Клаузиуса). (3.9)
(равенство Клаузиуса). (3.9)
Заметим, что уравнение Клапейрона-Менделеева описывает квазистатические процессы, происходящие в идеальных газах, и, следовательно, выражения (3.8) и (3.9) получены лишь для обратимых процессов в идеальных газах.
В термодинамике доказывается, что соотношения (3.8) и (3.9) можно распространить на обратимые процессы и в системах, отличных от идеального газа. При любом обратимом изменении состояния замкнутой системы энтропия системы не изменяется. Из равенств (3.1) и (3.8) имеем:
 . (3.10)
. (3.10)
Уравнение (3.10) называется термодинамическим тождеством или вторым началом термодинамики для обратимых процессов.
Важной особенностью энтропии является её поведение в необратимых процессах. Если круговой процесс необратим, то можно показать, что
|
|
|
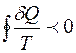 (неравенство Клаузиуса). (3.11)
(неравенство Клаузиуса). (3.11)
Рассмотрим процесс, при котором система необратимым образом переходит из равновесного состояния 1 в равновесное состояние 2. Необратимость перехода означает, что промежуточные состояния неравновесны. Вернём систему в исходное состояние каким – либо обратимым путем 2-1 (рис. 3.1). Получившийся круговой процесс необратим, потому что одна его часть необратима. Поэтому для него справедливо неравенство (3.11):
 . (3.12)
. (3.12)
Второй интеграл относится к обратимому процессу и равен:
 (3.13)
(3.13) 
Следовательно

или
 .
.
Если система замкнута, т.е изолирована от источников теплоты, то  и
и  или
или
 . (3.14)
. (3.14)
Отсюда следует, что энтропия замкнутой системы при необратимом процессе возрастает.
Обобщая выводы о поведении энтропии в замкнутых системах (3.9) и (3.14), можно утверждать, что энтропия замкнутой системы не убывает (второе начало термодинамики).
В необратимых процессах в замкнутых системах энтропия всегда возрастает, и это свойство также присуще энтропии, как энергии свойственно сохраняться при любых процессах в замкнутых системах.
Именно потому, что энергия обладает свойством сохраняться в замкнутой системе, она не может служить функцией, показывающей, в каком направлении идут процессы в такой системе. Энтропия в естественно идущих процессах всегда возрастающая, позволяет судить, какое направление процесса возможно и какое нет, какое состояние является начальным и какое конечным.
Рост энтропии в любом процессе продолжается не беспредельно, а лишь до определенного максимального значения, характерного для данной системы. Это максимальное значение энтропии соответствует состоянию равновесия, и после того как оно достигнуто, какие бы то ни было изменения состояния без внешнего воздействия прекращаются.
Энтропия как функция состояния существенно отличается от энергии. В то время как энергия не может быть ни создана, ни уничтожена, энтропия может создаваться и она постоянно создаётся во всяком процессе перехода к равновесию. Но, однажды созданная, она уже не может быть уничтожена: обратный процесс с уменьшением энтропии не может идти.
Методика эксперимента
Рассчитаем изменение энтропии при плавлении и нагревании вещества. Плавлением называется процесс перехода из твердого состояния вещества в жидкое. Плавление происходит при определённой для каждого вещества температуре и сопровождается поглощением энергии в виде скрытой теплоты плавления. «Скрытой» она называется потому, что подвод этой теплоты не сопровождается повышением температуры. Количество теплоты, которое требуется для того, чтобы расплавить единичную массу вещества, называется удельной теплотой плавления  .
.
|
|
|
Обратный процесс перехода из жидкого состояния в твёрдое называется кристаллизацией. Процесс кристаллизации происходит при той же температуре, что и плавление и сопровождается выделением энергии в виде скрытой теплоты кристаллизации, равной по величине теплоте плавления.
 Это ясно видно из графика зависимости темпе-ратуры охлаждающейся (на-гревающейся) жидкости от времени (рис. 3.2). Участок 1 кривой а даёт ход мо-нотонного понижения темпе-ратуры жидкости вследствие отвода тепла от неё. Горизонтальный участок 2 показывает, что при опре-делённом значении темпера-туры её понижение прекра-щается, несмотря на то, что отвод тепла продолжается. Через некоторое время температура опять начинает понижаться (участок 3). Температура, соответствую-щая участку 2, и есть температура кристаллизации. Выделяющееся при кристаллизации тепло компенсирует отвод тепла от вещества, и поэтому понижение температуры временно прекращается. После окончания процесса кристаллизации температура теперь уже твёрдого тела вновь начинает понижаться.
Это ясно видно из графика зависимости темпе-ратуры охлаждающейся (на-гревающейся) жидкости от времени (рис. 3.2). Участок 1 кривой а даёт ход мо-нотонного понижения темпе-ратуры жидкости вследствие отвода тепла от неё. Горизонтальный участок 2 показывает, что при опре-делённом значении темпера-туры её понижение прекра-щается, несмотря на то, что отвод тепла продолжается. Через некоторое время температура опять начинает понижаться (участок 3). Температура, соответствую-щая участку 2, и есть температура кристаллизации. Выделяющееся при кристаллизации тепло компенсирует отвод тепла от вещества, и поэтому понижение температуры временно прекращается. После окончания процесса кристаллизации температура теперь уже твёрдого тела вновь начинает понижаться.
Такой ход графика понижения температуры характерен для кристаллических тел. При охлаждении аморфных веществ скрытая
теплота не выделяется, и график охлаждения представляет собой монотонную кривую без «остановки» охлаждения (участок 2).
При плавлении на кривой нагревания также наблюдается остановка в повышении температуры, вследствие поглощения скрытой теплоты плавления – теплоты, за счёт которойпроисходит разрушение кристаллической решетки (кривая б на рис. 3.2).
Процесс плавления будет квазистатическим, если плавление происходит в среде, температура которой на бесконечно малую величину превышает температуру плавления Тпл. Поэтому можно считать, чтонеобходимая для плавления теплота сообщается телу при постоянной температуре Тпл. В этом случае
 .
.
Поглощенная телом в процессе плавления теплота Q равна произведению удельной теплоты плавления  на массу расплавившегося тела m:
на массу расплавившегося тела m:
 .
.
Таким образом, увеличение энтропии тела при квазистатическом плавлении равно:
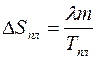 . (3.15)
. (3.15)
Если температура среды на бесконечно малую величину ниже температуры плавления, то возникает квазистатический процесс кристаллизации. При этом энтропия закристаллизовавшейся массы жидкости уменьшится настолько же, насколько увеличится энтропия при кристаллизации той же массы жидкости.
Изменение энтропии, отнесённое к единичной массе, называется её удельным приращением и определяется равенством
 .
.
При плавлении удельное приращение энтропии равно:  .
.
Рассмотрим процесс квазистатического нагревания вещества от температуры Т1 до температуры Т2. Если тело массы m поглощает тепло  и при этом его температура повышается на
и при этом его температура повышается на  , то
, то
 , (3.16)
, (3.16)
где с – удельная теплоёмкость вещества.
Подставив (3.16) в (3.8) находим, что
 . (3.17)
. (3.17)
Приращение энтропии олова при его нагревании от комнатной температуры Т0 до температуры плавления Тпл и последующем плавлении:
 . (3.18)
. (3.18)
Для того, чтобы по формуле (18) рассчитать приращение энтропии олова необходимо знать его температуру плавления, которую в данной лабораторной работе предлагается определить экспериментально по кривой зависимости температуры Т от времени t в процессах нагревания, плавления и кристаллизации олова.
|
|
|


