 |
Основные теоретические сведения
|
|
|
|
I начало термодинамики утверждает, что количество теплоты, переданное термодинамической системе, идёт на увеличение её внутренней энергии и на работу, совершаемую силами, приложенными со стороны системы к внешним телам:
 . (4.1)
. (4.1)
Элементарная работа, совершаемая газом при бесконечно малом изменении объёма  , когда давление газа
, когда давление газа 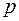 можно считать неизменным, равна
можно считать неизменным, равна
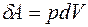 . (4.2)
. (4.2)
Для идеального газа элементарное изменение внутренней энергии  определятся изменением его температуры
определятся изменением его температуры  и равно:
и равно:
 , (4.3)
, (4.3)
где  – масса газа;
– масса газа;  – его молярная масса;
– его молярная масса;  – универсальная газовая постоянная,
– универсальная газовая постоянная,  – число степеней свободы молекул газа.
– число степеней свободы молекул газа.
Числом степеней свободы  называют число независимых координат, определяющих положение молекулы в пространстве. Например, число степеней свободы для одноатомной молекулы, равно трём, для жесткой двухатомной – пяти.
называют число независимых координат, определяющих положение молекулы в пространстве. Например, число степеней свободы для одноатомной молекулы, равно трём, для жесткой двухатомной – пяти.
Количество теплоты  , требуемое для нагревания газа, зависит от количества нагреваемого газа и от того, на сколько градусов должна быть изменена его температура. Поэтому для характеристики тепловых свойств газа используется теплоёмкость.
, требуемое для нагревания газа, зависит от количества нагреваемого газа и от того, на сколько градусов должна быть изменена его температура. Поэтому для характеристики тепловых свойств газа используется теплоёмкость.
Удельной теплоёмкостью газа называется величина, равная количеств теплоты, которую необходимо сообщить единице массы газа для увеличения его температуры на 1 К:
 . (4.4)
. (4.4)
Теплоемкость одного моля вещества называется молярной теплоемкостью:
 . (4.5)
. (4.5)
Значение теплоемкости газов зависит от условий их нагревания. Запишем I начало термодинамики и найдём теплоёмкости идеальных газов в различных термодинамических процессах.
В случае изохорного процесса  I начало термодинамики принимает вид:
I начало термодинамики принимает вид:
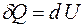 . (4.6)
. (4.6)
Учитывая (4.3) и (4.5), для молярной теплоёмкости при постоянном объёме получим:
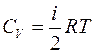 . (4.7)
. (4.7)
|
|
|
При изотермическом процессе ( ),
),  и I начало термодинамики запишется так:
и I начало термодинамики запишется так:
 . (4.8)
. (4.8)
Теплоёмкость газа становится бесконечно большой  . Это относится к идеальному изотермическому процессу, который возможен лишь при идеально хорошем обмене теплом между газом и внешними телами. Практически приблизиться к изотермическому процессу можно, заставляя его протекать настолько медленно, чтобы температура газа все время успевала выравниваться с температурой окружающих тел.
. Это относится к идеальному изотермическому процессу, который возможен лишь при идеально хорошем обмене теплом между газом и внешними телами. Практически приблизиться к изотермическому процессу можно, заставляя его протекать настолько медленно, чтобы температура газа все время успевала выравниваться с температурой окружающих тел.
Если в газе протекает процесс изобарный ( ), то I начало термодинамики имеет вид:
), то I начало термодинамики имеет вид:
 (4.9)
(4.9)
или
 . (4.10)
. (4.10)
Из уравнения Менделеева- Клапейрона имеем
 .
.
Тогда из уравнения (4.10) для молярной теплоёмкости газа при постоянном давлении, получаем
 . (4.11)
. (4.11)
Таким образом, молярная теплоёмкость при постоянном давлении  превосходит молярную теплоёмкость при постоянном объёме
превосходит молярную теплоёмкость при постоянном объёме  на универсальную газовую постоянную
на универсальную газовую постоянную  . Это объясняется тем, что при нагревании газа при постоянном давлении газ расширяется. Сообщаемое ему извне тепло идёт не только на увеличение запаса его внутренней энергии
. Это объясняется тем, что при нагревании газа при постоянном давлении газ расширяется. Сообщаемое ему извне тепло идёт не только на увеличение запаса его внутренней энергии  , но и на совершение работы
, но и на совершение работы  против внешних сил.
против внешних сил.
Процесс, протекающий в газе без теплообмена с окружающей средой ( ), называется адиабатным. В этом случае I начало термодинамики имеет вид
), называется адиабатным. В этом случае I начало термодинамики имеет вид

или
 . (4.12)
. (4.12)
Из соотношения (4.12) следует, что при адиабатном сжатии газа ( ), он нагревается (
), он нагревается ( ); при адиабатном расширении (
); при адиабатном расширении (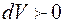 ) – газ охлаждается (
) – газ охлаждается ( ).
).
Таким образом, при адиабатном изменении объёма газа его температура не остаётся постоянной, а молярная теплоёмкость газа
равна 0.
Cоответственный расчёт позволяет связать это изменение температуры  с изменением его объёма
с изменением его объёма  . Пусть газ, занимая объём
. Пусть газ, занимая объём  , имел температуру
, имел температуру  , тогда при адиабатном изменении объёма до значения
, тогда при адиабатном изменении объёма до значения  , температура примет значение
, температура примет значение  , причём будет иметь место следующее соотношение:
, причём будет иметь место следующее соотношение:
 , (4.13)
, (4.13)
где  , т. е.
, т. е.  есть отношение теплоёмкостей газа при постоянном давлении и постоянном объёме. Величина
есть отношение теплоёмкостей газа при постоянном давлении и постоянном объёме. Величина  называется показателем адиабаты.
называется показателем адиабаты.
|
|
|
Воспользовавшись формулой Менделеева-Клапейрона, справедливой для каждого данного состояния газа, получим:
 ;
;
подставив это значение  в (4.13), получим:
в (4.13), получим:
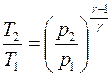 . (4.14)
. (4.14)
Формула (4.14), тождественная по своему смыслу с формулой (4.13), связывает изменение температуры, происходящее при адиабатном процессе, с изменением давления газа.
Приравнивая друг другу правые части выражений (4.13) и (4.14), получим
 или
или  , (4.15)
, (4.15)
т.е. при адиабатном изменении объёма давление газа 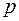 меняется обратно пропорционально объёму, взятому в степени
меняется обратно пропорционально объёму, взятому в степени  . Формула (4.15) носит название формулы Пуассона.
. Формула (4.15) носит название формулы Пуассона.
Практически процессы не носят строго адиабатного характера, так как невозможно осуществить полной термической изоляции газа. Но поскольку для совершения теплообмена необходимо некоторое время, то адиабатным можно считать процесс, который протекает настолько быстро, что система не успевает вступить в теплообмен с окружающей средой.
Методика эксперимента
Метод определения показателя адиабаты, предложенный Клеманом и Дезормом, основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатным и изохорным. Эти процессы на диаграмме  (рис. 3.1.) изображены кривыми соответственно 1-2 и 2-3.
(рис. 3.1.) изображены кривыми соответственно 1-2 и 2-3.
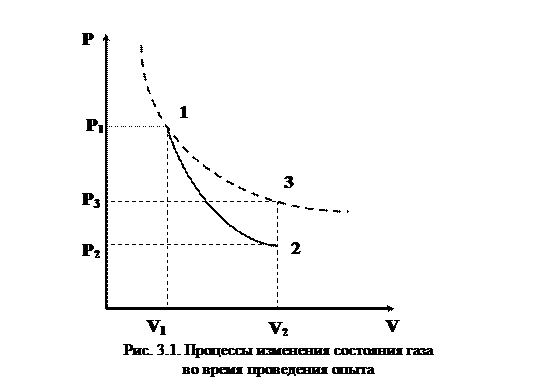
Если в баллон, соединенный с открытым водяным манометром, накачать воздух и подождать до установления теплового равновесия с окружающей средой, то в этом начальном состоянии 1 газ имеет параметры  , причем температура газа в баллоне равна температуре окружающей среды
, причем температура газа в баллоне равна температуре окружающей среды  , а давление
, а давление 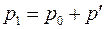 немного больше атмосферного.
немного больше атмосферного.
Если на короткое время соединить баллон с атмосферой, то произойдет адиабатное расширение воздуха. При этом воздух в баллоне перейдет в состояние 2, его давление понизится до атмосферного  . Масса воздуха, оставшегося в баллоне, расширяясь, займет весь объем
. Масса воздуха, оставшегося в баллоне, расширяясь, займет весь объем  . При этом температура воздуха, оставшегося в баллоне, понизится до
. При этом температура воздуха, оставшегося в баллоне, понизится до  . Поскольку процесс 1-2 адиабатный, к нему можно применить уравнение Пуассона (4.15):
. Поскольку процесс 1-2 адиабатный, к нему можно применить уравнение Пуассона (4.15):
 или
или 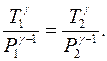
Отсюда
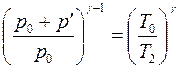 . (4.16)
. (4.16)
После кратковременного соединения баллона с атмосферой охлажденный из-за адиабатного расширения воздух в баллоне будет нагреваться (процесс 2-3) до температуры окружающей среды  при постоянном объеме
при постоянном объеме  При этом давление в баллоне поднимется до
При этом давление в баллоне поднимется до 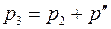 . Так как процесс 2-3 изохорный, то он удовлетворяет закон Шарля
. Так как процесс 2-3 изохорный, то он удовлетворяет закон Шарля  , отсюда
, отсюда
|
|
|
 . (4.17)
. (4.17)
Из уравнений (4.16) и (4.17) получаем:
 .
.
Прологарифмируем последнее соотношение:
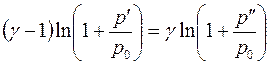 . (4.18)
. (4.18)
Избыточные давления  и
и  намного меньше атмосферного давления
намного меньше атмосферного давления  и, следовательно,
и, следовательно,  и
и 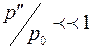 . Учитывая, что
. Учитывая, что 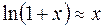 при
при  , перепишем выражение (4.18) следующим образом:
, перепишем выражение (4.18) следующим образом:
 .
.
Отсюда для показателя адиабаты  получаем:
получаем:
 . (4.19)
. (4.19)
Избыточные давления 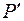 и
и  измеряют с помощью
измеряют с помощью  – образного манометра по разности уровней жидкости, обладающей плотностью
– образного манометра по разности уровней жидкости, обладающей плотностью  :
:
 ,
,  (4.20)
(4.20)
Из соотношений (4.19) и (4.20) получаем рабочую формулу для определения  :
:
 . (4.21)
. (4.21)
|
|
|


