 |
Обработка воды коагулянтами
|
|
|
|
В природных водах содержатся одновременно частицы по размерам соответствующие грубодисперсным системам и коллоидам. Грубодисперсные частицы удаляются отстаиванием. А коллоиды не отстаиваются.
Воды бывают мутные и цветные.
В мутных водах присутствуют: коллоидные частицы алюмосиликатов (глинистые), кремниевой кислоты, органоминеральных комплексов почвы.
Коллоидные частицы примесей природных вод, как правило, имеют отрицательный заряд.
Основу глинистых частиц образуют гидроалюмосиликаты.
Гумусовые соединения занимают промежуточное положение между коллоидами и ВМС. Они более устойчивы к действию электролитов и обладают защитными свойствами по отношению к коллоидным растворам гидроксидов металлов. Они затрудняют процессы очистки воды.
Метод обработки воды, направленный на удаление веществ – коллоидов с помощью химических реагентов называется коагулированием. Вещества, вызывающие разрушение коллоидов, называются коагулянтами.
Коагулирование применяется для осветления мутных и обесцвечивания цветных вод. Наряду с коллоидами при этом удаляются грубодисперсные примеси, планктон, бактерии и вирусы.
Коагулянты представляют собой соли слабых оснований и сильных кислот. Они гидролизуются:
Al3+ + H2O ↔ (AlOH)2+ + H+
(AlOH)2+ + H2O ↔ Al (OH)2+ + H+
Al(OH)2+ + H2O ↔ Al(OH)3 + H+
Могут образоваться аквакомплексы, тогда гидролиз:
[Al (H2O)6]+3 + H2O = [ Al (H2O)5OH]+2 + H3O+
Эффективность действия коагулянта определяется полнотой гидролиза с образованием труднорастворимых гидроксидов.
Для увеличения степени гидролиза необходимо связывать ионы H+. Это достигается за счёт HCO3-,CO32- ,OH-, присутствующих в воде (щелочной резерв).
Al2(SO4)3 + 3Ca(HCO3)2 + 6H2O → 2Al(OH)3 + 3CuSO4 + 6H2CO3
|
|
|
∕ \
H2O CO2
Гидроксид алюминия обладает амфотерными свойствами. Его образование начинается при pH >4,5, а при pH >8,5 происходит растворение Al(OH)3.
С образованием алюминатов
Al(OH)3 + Na OH = Na3[Al(OH)6]
гексагидроксоалюминат
натрия
В щелочной среде образуется анион метаалюминиевой кислоты AlO-2. В результате гидролиза:
AlO-2 + 2H2O → Al(OH)3 + OH-
На этом основано применение его как коагулянта. Гидроксид железа Fe(OH)3 образуется в более широком диапазоне pH. Коагулирование воды включает три стадии.
1.Образование коллоидного раствора гидроокиси металла в результате полного гидролиза коагулянта.
2.Коагуляцию образовавшегося золя коагулянта под действием анионов воды и его взаимодействие с коллоидными и грубодисперсными примесями воды.
3.Процесс хлопьеобразования, завершающийся седиментацией.
Коагуляция Fe(OH)3 или AL(OH)3 происходит за счёт сжатия диффузионного слоя коллоидных частиц. Противоионы диффузионного слоя переходят в адсорбционный, уменьшается электрокинетический потенциал (концентрационная коагуляция).
Скоагулировавшиеся частицы Fe(OH)3 и Al(OH)3 обладают хорошо развитой поверхностью и являются хорошими адсорбентами для коллоидных примесей воды.
Может иметь место взаимная коагуляция. Коагуляция коллоидов Al(OH)3 и Fe(OH)3 вызывается анионами (SO42-,HCO3-,Cl-) содержащимися в воде.
Процесс коагуляции идёт быстро, необходимо энергичное перемешивание. На процесс коагуляции влияет температура (устойчивость коллоидов увеличивается, т.к. увеличивается тепловое движение частиц).
Количество введённого в воду коагулянта (мг/л, мг-экв/л, г/м3, г-экв/м3) называется дозой коагулянта.
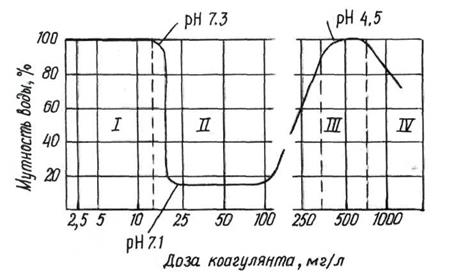
|
Минимальная концентрация коагулянта, отвечающая наибольшему осветлению или обесцвечиванию воды, называется оптимальной дозой коагулянта. Она определяется опытным путём и зависит от солевого состава, жесткости, щелочности и т.д.
|
|
|
Рис.12. Кривая коагуляции.
Оптимальной дозой считается минимальное количество коагулянта, которое при пробном коагулировании даёт крупные хлопья и максимальную прозрачность воды через 15-20 минут.
Во время паводка доза увеличивается на 50 %. При температуре ниже 4 0С дозу увеличивают в 2 раза.
Мягкие воды плохо коагулируются (мало анионов). Для цветных вод:
Д=4√Ц,
где Д – доза Al2(SO4)3 мг/л
Ц – цветность воды по платиново-кобальтовой шкале, град.
При малой щелочности и низкой температуре проводят коагуляцию с подщелачиванием. Обычно используют известь и соду. При этом:
2FeCl3 + 3Ca(OH)2 → 2Fe(OH)3 ↓+ 3CaCl2
Al2(SO4)3 + Na2CO3 + H2O → Al(OH)3 + Na2SO4 + H2CO3
Количество щёлочи определяют:
Дщ = Дк – Щ + 1,
где Дщ – доза щёлочи, мг-экв/л;
Дк – доза коагулянта, мг-экв/л;
Щ – щелочность воды, мг-экв/л;
1 – избыток щелочного реагента, мг-экв/л.
|
|
|


