 |
Тема 2. Требования, предъявляемые к воде хозяйственно - бытового и промышленного водоснабжения
|
|
|
|
1. Указать правильное утверждение:
а) требования к воде промышленного водоснабжения определяются технологией производства;
б) требования к воде промышленного водоснабжения едины ко всем видам водопользования;
в) требования к воде промышленного водоснабжения обусловлены проблемой сброса вод в открытые водоемы.
2. Указать ПДК по железу для вод применяемых для охлаждения:
а) 0,01 мг/л;
б) 10 мг/л;
в) 0,1 мг/л.
3. Указать ПДК по сероводороду для воды, применяемой в качестве охлаждающей жидкости:
а) ПДК  ≤ 0,5 мг/л;
≤ 0,5 мг/л;
б) ПДК  ≥ 0,5 мг/л;
≥ 0,5 мг/л;
в) ПДК  = 0,5 мг/л;
= 0,5 мг/л;
4. ПДК по жесткости на воду, применяемую для охлаждения:
а) 4 ммоль/дм3;
б) 0,17 ммоль/дм3;
в) 2,8 ммоль/дм3.
5. Требования к воде, идущей на питание паровых котлов:
а) Общая жесткость 0,017 ммоль/л; минимальные значения растворенного кислорода и солесодержания;
б) Общая жесткость 2,8 ммоль/дм3 ; минимальное солесодержание;
в) Карбонатная жесткость 0,017; минимальное значение растворенного кислорода; солесодержание не лимитируется.
6. Указать правильное утверждение: первая группа примесей воды, по отношению ее к дисперсной среде -…
а) это нерастворимые в воде примеси, образующие коллоидные растворы, подверженные седиментации;
б) это нерастворимые в воде примеси, образующие кинетически неустойчивые системы;
в) это растворимые в воде примеси, образующие кинетически устойчивые системы – истинные растворы.
7. Вторая группа примесей воды по отношению их к дисперсионной среде – это:
а) грубодисперсные системы, удаляемые флотацией и электрофорезом;
б) истинные растворы, к которым применимы реагентные методы;
в) коллоидные примеси, выделяемые из воды введением реагентов, вызывающих их коагуляцию.
|
|
|
8. Третья группа примесей воды по отношению их к дисперсной среде, это-
а) коллоидные растворы, удаляемые методом коагуляции;
б) грубодисперсные системы кинетически неустойчивые и склонные к содиментации;
в) молекулярные растворы, образующие гомогенные растворы и удаляющиеся химическими реагентами.
9. Какие примеси природных вод относятся к третьей группе по их отношению к дисперсионной среде:
а) газы, органические вещества, продукты жизнедеятельности водных организмов;
б) коллоидные растворы, продукты распада органики;
в) грубодисперсные системы – взвеси, эмульсии, зоо – и фитопланктон.
10. Какими методами удаляются примеси воды, относящиеся к четвертой группе по их соотношению к дисперсной среде?
а) флотация, электрофорез, адгезия;
б) электрофорез, коагуляция, адгезия;
в) ионный обмен, электродиализ.
11. Что такое адгезия?
а) прилипание частиц к поверхности сорбента;
б) разрушение частиц под действием электрического тока;
в) введение реагентов, вызывающих агрегирование частиц.
12. На каких методах основано удаление примесей воды, относящихся к первой группе по их отношению к дисперсионной среде?
а) электрофорез, коагуляция;
б) седиментация, адгезия;
в) ионный обмен, электродиализ.
13. Какие ионы обуславливают общую жесткость воды:
а) Са2+, Mg2+;
б) Na2+, K+;
в) Mg2+, Fe2+.
14. Какие соли обуславливают временную жесткость воды:
а) Ca(HCO3)2, CaCO3, MgCO3;
б) Mg(HCO3)2, Ca(HCO3)2;
в) MgCO3, Mg(HCO3)2.
15. Какие соли обуславливают постоянную жесткость воды:
а) Ca(HCO3)2, CaCl, CaSO4;
б) MgCO3, MgCl2, Mg(HCO3)2;
в) CaCl2, MgCl2, CaSO4, MgCO3.
16. Чему равен один миллиграмм – эквивалент ионов Са2+ ?
а) 20 мг;
б) 20 г;
в) 20∙ 10-3 мг.
17. Чему равна жесткость воды (моль/дм3) обусловленная содержанием Са2+ равным 20 мг/л.
а) 1 ммоль /дм3;
б) 20 ммоль /дм3;
в) 1∙ 10-3 ммоль/дм3.
18. Жесткость воды составляет 1,5 ммоль/дм3.
а) это вода средней жесткости;
б) это мягкая вода;
в) это вода очень мягкая.
|
|
|
19. По какому критерию жесткость воды относится к карбонатной?
а) по существенному аниону;
б) по сопутствующему катиону;
в) по величине жесткости.
20. Как устраняется временная жесткость воды?
а) кипячением в течение часа;
б) применением железных и алюминиевых реагентов;
в) методом дегезации.
21. Указать продукты, образующиеся при термическом методе умягчения воды:
а)CaCO3, Mg (OH)2;
б)CaCl2, MgCl2;
в)Ca(OH)2, Mg(OH)2.
22. Какой газ образуется при термическом методе умягчения воды:
а) кислород;
б) углекислый газ;
в) сероводород.
23. На чем основаны реагентные методы умягчения воды:
а) перевод ионов Са2+, Mg2+ в газообразные соединения;
б) перевод ионов Са2+, Mg2+ в труднорастворимые соединения;
в) перевод ионов Са2+, Mg2+ в коллоидную фракцию с последующей коагуляцией.
24. От чего зависит остаточная концентрация Са2+ и Мg2+ при применении реагентных методов умягчения воды:
а) от величины произведения растворимости образующихся соединений;
б) от величины константы гидролиза образующихся соединений;
в) от величины константы диссоциации и электродных потенциалов образующихся соединений.
25. Что такое известкование воды?
а) это перевод заметно растворяемых гидрокарбонатов кальция и магния в труднорастворимые соединения;
б) это образование хлоридов и сульфатов Са2+ и Mg2+ в целях умягчения воды;
в) это умягчение воды с образованием извести и последующем ее осаждении.
26. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
27. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
28. Какие цели достигаются при известковании воды?
а) снижаются: постоянная жесткость, величина рН, меняется углекислое равновесие;
б) снижаются: карбонатная жесткость, общее солесодержание, концентрация свободной угольной кислоты;
в) снижаются: общая жесткость, величина рН, концентрация растворенного кислорода.
29. Какие приемы используются для более полного умягчения воды.
|
|
|
а) повышение давления, увеличение рН, увеличение температуры;
б) повышение температуры, перемешивание, создание избытка извести;
в) повышение температуры, создание избытка извести, введение катализатора.
30. Как связаны между собой окисляемость воды и формирование осадка при известковании воды.
а) чем выше окисляемость воды, тем хуже кристаллизация осадка;
б) чем ниже окисляемость, тем хуже кристаллизация осадка;
в) формирование осадка при известковании воды не зависит от величины окисляемости воды.
31. Указать выражение для определения оптимальной дозы извести:
а) Ди = 28[ЖК +  + 0,5]
+ 0,5]  ;
;
б) Ди = 28[Ж +  + 0,5]
+ 0,5]  ;
;
в) Ди = 28[ЖК + 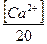 + 0,5]
+ 0,5]  .
.
32. Сущность содово – известкового метода умягчения воды:
а) обработка воды карбонатом натрия и гидроксидом кальция;
б) обработка воды карбонатом магния и гидроксидом магния;
в) обработка воды гидроксидом кальция и карбонатом кальция.
33. Какая реакция протекает при добавлении в воду соды?
а) CaSO4 + Na2CO3 = CaCO3 ↓ + Na2SO4;
б) CaSO4 + 2NaCl = CaCl2 + Na2SO4;
в) CaSO4 + 2NaOH = Ca(OH)2 + Na2SO4;
34. Указать выражение, по которому рассчитывается доза соды при содово - известковом методе умягчения воды.
а) Дс = 53 [ЖНК + 1]  ;
;
б) Дс = 53 [Жобщ + 1] 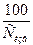 ;
;
в) Дс = 53 [Ж + 1]  ;
;
35. Преимущества термохимического метода умягчения воды.
а) образование крупных хлопьев, уменьшение дозы извести, степень умягчения воды 0,2 -0,3 мг –экв/л.;
б) уменьшение солесодержания, понижение величины жесткости до нуля, нейтральная реакция среды;
в) уменьшение дозы извести, улучшение органолептических свойств воды, снижение содержания газов.
36. Недостатками реагентных методов умягчения воды являются:
а) недостаточная степень умягчения, расход продуктов, сложность технологического осуществления;
б) расход энергии, сложность технологического осуществления, высокая степень умягчения;
в) расход реагентов, расход энергии, сложность осуществления.
37. Достоинства ионообменного метода умягчения воды.
а) не образуется осадка, не нужно дозирование реагента, уменьшение содержания;
б) дозировка реагента, плотный осадок, регуляция солесодержания;
|
|
|
в) улучшение органолептических свойств воды, снижение содержания газов.
38. Статистически объемная емкость – это:
а) число мг –эквивалентов ионов, обменивающихся при контакте раствора с определенным количеством ионитов;
б) определяется количеством ионов, поглощенных объемом набухшего ионита в процессе фильтрования до появления этих ионов в фильтрате;
в) характеризуется общим числом активных групп ионита в единице объема смолы.
39. Катионит универсальный КУ -2, это:
а) сополимер метилметакрилата с дивинилбензолом.
б) сульфированный сополимер стирола с дивинилбензолом.
в) продукт обработки бурого угля серной кислотой.
40. Что такое обессоливание воды?
а) Метод обработки воды, направленный на снижение общего солесодержания.
б) Частный случай опреснения воды.
в) Метод обработки воды приводящий к осветлению и обесцвечиванию воды.
|
|
|


