 |
Обжиг медных концентратов в кипящем слое
|
|
|
|
6.1. ОБЖИГ ПРИ ОБОГАЩЕНИИ ДУТЬЯ КИСЛОРОДОМ
Необходимо определить состав и выход огарка, расход дутья, материальный и тепловой балансы обжига медной шихты состава, приведенного в таблице 22, на дутье, обогащенном кислородом до 35%. Степень десульфуризации при обжиге принимаем 55%, температуру обжига 8500С. Расчет ведем на 100 кг шихты.
В качестве флюса для плавки используют песчаники, добавляемые к концентрату перед обжигом. Подготовка шихты осуществляется смешиванием флюсовой и концентратной пульп, фильтрацией и сушкой шихты в барабанных сушилках. Состав шихты, поступающей на обжиг, приведен в таблице 22.
ТАБЛИЦА 22 Состав медной шихты, %
| Минералы | Cu | Ni | S | Fe | Всего |
| CuFeS2 | 17,3 | – | 17,45 | 15,25 | 50,0 |
| CuFe2S3 | 3,9 | – | 5,8 | 6,9 | 16,6 |
| (NiFe)1,2S2 | – | 1,1 | 1,2 | 1,20 | 3,50 |
| FeS | – | – | 2,65 | 4,65 | 7,3 |
| SiO2 | – | – | – | – | 13,0 |
| CaO | – | – | – | – | 1,5 |
| MgO | – | – | – | – | 0,60 |
| Al2O3 | – | – | – | – | 2,0 |
| Прочие (H2O+CO2) | – | – | – | – | 5,5 |
| 21,2 | 1,1 | 27,1 | 28,0 |
Примечание. СаО и MgO присутствуют в шихте в форме карбонатов.
Определим количество серы, диссоциирующей при обжиге. Для простоты расчета примем, что все высшие сульфиды в процессе обжига разлагаются полностью. В действительности в зависимости от принятых величин десульфуризации и температуры процесса диссоциация высших сульфидов происходит частично. Но для определения количества кислорода, необходимого для окисления сульфидов, указанное обстоятельство не имеет значения.
По реакции 2CuFeS2 ® Cu2S + 2 FeS + S. образуется, кг:
Sсвоб 
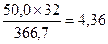
FeS 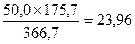
Cu2S 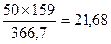
По реакции 2 CuFe2S3 ® Cu2S + 4 FeS + S образуется, кг:
Sсвоб 
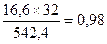
FeS 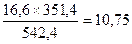
Cu2S 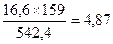
По реакции 3 (NiFe)1,2S2®Ni3S2 + 3.6 FeS + 0.4 S образуется, кг:
Sсвоб 
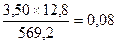
FeS 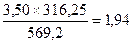
Ni3S2 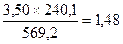
Всего выделится свободной серы 4,36+0,98+0,08=5,42 кг.
При 55% десульфуризации в газы перейдет серы 27,10•55/100 = 14,90 кг, в том числе за счет окисления сернистого железа 14,90–5,42=9,48 кг. Образуется сернистого ангидрида 14,9•2=29,8 кг.
|
|
|
Принимаем, что в процессе обжига сернистое железо окисляется до Fe3O4 по реакции 3FeS + 5О2 = Fe3O4 + 3SO2. На практике наряду с образованием Fe3O4 может происходить образование FeO и Fe2O3.
Количество окислившегося сернистого железа 9,48•263,5/96=26,0 кг, В огарке останется сернистого железа
23,96+10,75+1,94+7,30–26,0=17,95 кг.
Для окисления FeS потребуется кислорода
160•26,0/263,5=15,8 кг.
Результаты расчетов сводим в таблицу 23.
ТАБЛИЦА 23 Рациональный состав огарка, кг
| Соединения | Cu2S | FeS | Ni3S2 | Fe3O4 | Всего |
| Cu | 21,2 | – | – | – | 21,2 |
| Fe | – | 11,47 | – | 16,53 | 28,0 |
| Ni | – | – | 1,1 | – | 1,1 |
| S | 5,34 | 6,48 | 0,38 | – | 12,2 |
| SiO2 | – | – | – | – | 13,0 |
| CaO | – | – | – | – | 1,5 |
| MgO | – | – | – | – | 0,6 |
| Al2O3 | – | – | – | – | 2,0 |
| O2 | – | – | – | 6,3 | 6,3 |
| 26,54 | 17,95 | 1,48 | 22,83 | 85,90 |
Таким образом, выход огарка составляет 85,9%.
Для определения материального баланса обжига рассчитаем количество и состав отходящих газов. Для окисления элементарной серы по реакции S+O2=SO2 потребуется кислорода 5,42•32/32=5,42 кг. Образуется при этом сернистого ангидрида, 5,42•2=10,84 кг. Всего кислорода с учетом окисления сернистого железа потребуется 5,42+15,8=21,22 кг.
Количество дутья при содержании кислорода 35% составит
22,4(21,22•100/35)/32=42,4 м3.
Азота в этом дутье будет 42,40•65/100=27,60 м3. Находим состав отходящих газов:
| кг | м3 | % | кг | м3 | % | ||
| SO2 | 29,8 | 10,43 | 24,0 | H2O | 3,64 | 4,53 | 10,4 |
| N2 | 34,5 | 27,60 | 63,4 | CO2 | 1,86 | 0,98 | 2,2 |
Полученный состав отходящих газов является теоретическим. На практике из-за наличия неорганизованных подсосов воздуха через неплотности содержание SO2 в газах, поступающих на сернокислотное производство, не превышает 7,0% при воздушном дутье и 10% при дутье, обогащенном кислородом. Определим подсосы воздуха при работе на кислородном дутье, если содержание SO2 в газах сернокислотного производства равно 10%.
|
|
|
Всего в газах содержится 10,43 м3 SO2. После снижения содержания SO2 до 10% объем газов составит 10,43/0,1=104,3 м3.
Отсюда находим подсосы воздуха: 104,3–43,54=60,76 м3. Азота в нем 60,76•0,79=48,0 м3, кислорода 60,76•0,21=12,76 м3.
Находим состав газа, поступающего на производство серной кислоты, % (объемн.)
| м3 | % (объемн.) | |
| SO2 | 10,43 | 10,0 |
| N2 | 75,60 | 72,5 |
| O2 | 12,76 | 12,3 |
| H2O | 4,53 | 4,3 |
| CO2 | 0,98 | 0,9 |
| 104,3 | 100,0 |
Для проверки проделанных расчетов составляем материальный баланс обжига (таблица 24).
ТАБЛИЦА 24. Материальный баланс обжига медьсодержащей шихты, кг
| Материалы баланса | Всего | В том числе | |||||||
| Cu | Fe | S | породы | H2O | O2 | N2 | CO2 | ||
| Загружено: шихты воздуха | 55,72 | 21,2 – | 28,0 – | 27,1 – | 17,1 – | 3,64 – | – 21,22 | – 34,50 | 1,86 – |
| Итого | 155,72 | 21,2 | 28,0 | 27,1 | 17,1 | 3,64 | 21,22 | 34,50 | 1,86 |
| Получено: огарка газов | 85,9 69,82 | 21,2 – | 28,0 – | 12,2 14,9 | 17,1 – | – 3,64 | 6,3 14,92 | – 34,50 | – 1,86 |
| Итого | 155,72 | 21,2 | 28,0 | 27,1 | 17,1 | 3,64 | 21,22 | 34,50 | 1,86 |
Для составления теплового баланса процесса произведем расчет прихода тепла от экзотермических реакций, протекающих при обжиге.
При окислении элементарной серы по реакции
S+О2 = SO2 + 70960 ккал/кг-моль
выделится 5,42•70960/32=12019 ккал тепла.
При окислении сернистого железа по реакции
3FeS + 5О2=Fe3O4 + 3SO2 + 411720 ккал
выделится (26•411720)/(87,85•3)=40617 ккал тепла.
Примем, что расход тепла на разложение CuFe2S3 и NiFe1,2S2 аналогичен расходу тепла на разложение CuFeS2 по реакции
2CuFeS2→Cu2S + 2FeS + S – 18630 ккал/(кг-моль).
На разложение 1 кг этих сульфидов потребуется 18630/366,7=50,8 ккал тепла. На разложение 70,1 кг (CuFeS2 + CuFe2S3 + NiFe1,2S2), таблица 22, потребуется 70,1•50,8=3561 ккал* тепла.
* Часто считают тепловой эффект диссоциации серы из всех высших сульфидов равным–20 ккал/моль.
На разложение известняка потребуется тепла
СаСО3→СаО + СО3 – 42498 ккал.
На 1 кг СаСО3 расходуется тепла 2498/100=425 ккал. На весь известняк 2,7•425=1148 ккал.
На разложение MgCO3 по реакции
MgCO3→MgO + СО2 – 26470 ккал
потребуется тепла 1,26•26470/84=394 ккал.
Всего на эндотермические реакции потребуется тепла 3561+1148+394=5103 ккал. Таким образом, приход тепла от реакций составит 12019+40617–5103=47533 ккал.
Приход тепла с шихтой при 250С равен 100•0,22•25=550 ккал. Приход тепла с дутьем равен 60,63•0,22•25=334 ккал.
|
|
|
Всего приход тепла составит 47533+550+334=48417 ккал.
Определим расход тепла с огарком 85,9•0,22•850=16063 ккал плюс унос газами. По таблице 25 находим, что расход тепла на нагревание газов до 8500С составит, ккал/м3:
| SO2 | (477,1–418,4)/100•50+418,4 | =447,75 |
| N2 | (298,0–262,4)/100•50+262,4 | =280,20 |
| H2O | (363,1–317,4)/100•50+317,4 | =340,25 |
| CO2 | (469,9–410,5)/100•50+410,5 | =440,20 |
Расход тепла с отходящими газами составит, ккал:
| SO2 | 10,43•447,75=4670,0 | H2O | 4,53•340,25=1541,3 |
| N2 | 27,60•280,2=7733,5 | CO2 | 0,98•440,2=431,4 |
Всего, суммируя, получим 14376,2 ккал. Потери тепла через кладку и лучеиспусканием по данным практики принимаем равными 10% от прихода тепла, т.е. 48417•10/100=4842 ккал.
Всего расход тепла составит 16063+14376,2+4842=35281,2 ккал. Отсюда видим, что избыток тепла равен 48417–35281,2=13135,8 ккал, и, следовательно, печь необходимо оборудовать холодильниками (см. § 32.6).
Таблица 25 Расход тепла на нагревание газов, ккал/м3
| t,0C | CO2 | H2O | Воздух | N2 | O2 | H2 | CO | SO2 | CH4 | C2H4 |
| 0,0 40,92 86,12 134,7 185,6 239,1 295,3 352,3 410,5 469,9 530,1 591,5 652,7 714,7 777,8 840,7 903,9 967,2 | 0,0 35,83 72,47 100,0 148,9 189,0 230,3 273,0 317,4 363,1 409,6 457,5 506,0 555,7 607,2 658,7 711,1 765,4 819,3 873,2 929,0 958,8 | 0,0 31,06 62,56 94,51 127,3 160,6 194,6 229,3 264,3 300,8 337,3 374,0 411,2 448,9 486,9 542,8 562,6 600,8 639,4 677,4 716,6 755,3 793,2 | 0,0 31,10 62,47 94,24 126,6 159,5 193,0 227,1 262,4 298,0 334,2 371,1 408,0 444,9 482,9 520,8 558,3 596,3 635,3 673,2 712,2 750,6 790,3 | 0,0 31,46 63,81 97,79 131,7 167,1 203,2 239,9 277,4 315,3 353,4 391,7 430,5 470,5 509,8 548,9 588,3 628,1 669,1 710,5 751,5 791,8 832,5 | 0,0 30,88 62,02 93,30 124,6 156,0 187,7 219,6 259,6 284,7 317,7 351,0 385,6 420,0 454,8 495,0 525,5 561,4 598,4 635,0 672,0 709,4 748,1 | 0,0 31,10 62,47 94,51 127,1 160,4 191,6 229,3 265,2 301,2 337,8 375,0 412,3 460,2 487,9 525,4 564,0 602,3 641,0 680,0 718,4 758,1 797,1 | 0,0 43,46 90,58 140,8 193,5 247,9 303,9 360,8 418,4 477,1 535,9 595,4 654,0 715,3 775,3 835,3 895,0 956,6 | 0,0 38,64 83,89 135,2 192,2 254,5 322,1 394,2 470,1 549,4 632,2 - - - - - - - - - - - - | 50,2 111,29 181,4 260,1 345,6 437,2 533,5 639,0 714,4 851,4 - - - - - - - - - - - - |
Сведем полученные данные в таблицу теплового баланса (таблица 26).
ТАБЛИЦА 26. Тепловой баланс обжига медной шихты
| Приход тепла | Расход тепла | ||||
| Статьи баланса | ккал | % | Статьи баланса | ккал | % |
| Химические реакции Шихта Дутье | 98,2 1,1 0,7 | Газы Огарок Через кладку Через холодильник | 14376,2 16063,0 4842,0 13135,8 | 29,7 33,2 10,0 27,1 | |
| ИТОГО | ИТОГО |
|
|
|
Определим расход воды, необходимый для удаления избыточного тепла. Принимаем, что холодильник работает в контуре котла-утилизатора, а пар имеет давление 40 ат. Количество тепла, подлежащее удалению из слоя, равно 13135,8 ккал. Выход пара от использования этого тепла составит
13135,8/(669–150)=25,3 кг,
где 669 – энтальпия насыщенного пара при давлении 40 ат;
150 – энтальпия воды при давлении 40 ат (вода подогревается отдельно).
ОБЖИГ ПРИ ВОЗДУШНОМ ДУТЬЕ
Произведем расчет обжига медной шихты предыдущего примера на воздушном дутье.
В соответствии с выполненными расчетами для протекания реакций процесса на 100 кг шихты требуется 21,22 кг кислорода. Количество дутья в этом случае составит: 21,22•22,4•100/32/21=70,7 м3. В нем кислорода 70,7•0,21=14,8 м3, азота 70,7•0,79=55,9 м3.
В результате обжига получим отходящие газы следующего состава:
| кг | м3 | % (объемн) | кг | м3 | % (объемн) | ||
| SO2 | 29,8 | 10,43 | 14,5 | H2O | 3,64 | 4,53 | 6,3 |
| N2 | 69,9 | 55,9 | 77,8 | CO2 | 1,86 | 0,98 | 1,4 |
Определим количество тепла, уносимого газами при 8500С (предыдущий расчет), ккал:
| SO2 | 447,75•10,43 | =4670 | H2O | 340,25•4,53 | =1541,3 |
| N2 | 280,2•55,9 | =15663 | CO2 | 440,2•0,95 | =431,4 |
т.е. в сумме получим 22305,7 ккал.
Расход тепла при работе на воздушном дутье составит 16063+22305,7+4842=43210,7 ккал.
При приходе тепла 48417 ккал образуется избыток тепла, равный 5206,3 ккал, обеспечивающий получение 5206,3/519=10 кг пара.
ОТРАЖАТЕЛЬНАЯ ПЛАВКА
Переработка медных концентратов на штейн методом отражательной плавки занимала ведущее место в производстве меди до последнего времени. Это обстоятельство объясняется простотой процесса и относительно невысокими капитальными вложениями при крупных объемах производства. Основной недостаток отражательной плавки - невозможность регулирования десульфуризации и выделение большого объема отходящих газов, что делает процесс нерентабельным в случае их очистки от вредных веществ, пыли и, в частности, от SO2.
Поскольку в последнее время значительно возросли требования по охране окружающей среды, в особенности чистоты воздушного бассейна, в мировой практике наблюдается замена отражательной плавки электроплавкой, плавкой во взвешенном состоянии и переработкой концентратов в конверторах.
В то же время плавка в отражательных печах пока еще сохраняется, а основные положения ее расчета идентичны расчетам электроплавки и плавки во взвешенном состоянии.
|
|
|


