 |
Кристаллическое строение материалов
|
|
|
|
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
А. Г. Мельников, И. А. Хворова, Е. П. Чинков
МАТЕРИАЛОВЕДЕНИЕ
Рекомендовано в качестве учебного пособия
Редакционно-издательским советом
Томского политехнического университета
Издательство
Томского политехнического университета
УДК 620.22(075.8)
ББК 30.3я73
М482
Мельников А.Г.
М482 Материаловедение: учебное пособие / А.Г. Мельников, И.А. Хворова, Е.П. Чинков; Национальный исследовательский Томский политехнический университет. − Томск: Изд-во Томского политехнического университета, 2012. – 200 с.
В учебном пособии в краткой форме изложены закономерности формирования структуры и свойств металлических и неметаллических материалов, используемых в приборостроении. Большое внимание уделено фундаментальным основам теории и технологии термической обработки металлических материалов. Учебное пособие соответствует программе дисциплины и предназначено для студентов немашиностроительных специальностей, обучающихся по направлениям: 200400 «Оптотехника», 200300 «Биомедицинская инженерия», 200500 «Метрология, стандартизация и сертификация», 221400 «Управление качеством», 550200 «Автоматизация и управление», 652000 «Мехатроника и робототехника».
УДК 620.22(075.8)
ББК 30.3я73
Рецензенты
Доктор технических наук, профессор,
старший научный сотрудник Института физики
прочности и материаловедения СО РАН
Б. П. Гриценко
Главный инженер ООО «Томский
инструментальный завод».
Н. В. Коробейников
© ГОУ ВПО «Национальный исследовательский Томский политехнический университет», 2012
© Мельников А.Г., Хворова И.А., Чинков Е.П. 2012
© Оформление. Издательство Томского
политехнического университета, 2012
|
|
|
ВВЕДЕНИЕ
Получение, разработка новых материалов и способы их обработки являются основой современного производства, уровень развития которого определяет научно-технический и экономический потенциал страны. Проектирование конкурентно-способных изделий, организация их производства невозможны без достаточного уровня знаний в области материаловедения и технологии конструкционных материалов.
Материаловедение – наука о строении и свойствах металлических и неметаллических материалов, их взаимосвязи и возможности изменения для рационального использования в технике.
Разнообразие свойств материалов является главным фактором, предопределяющим их широкое применение в технике. В современной технике имеется огромное количество различных устройств, машин и механизмов, строительных конструкций, приборов, оборудования и инструментов, которые работают в жестких условиях износа, а также воздействия высоких нагрузок, агрессивных сред, высоких и низких температур. Для того чтобы обеспечить их работоспособность, надежность и долговечность, инженер должен иметь представление о возможности формирования необходимых свойств современных материалов, уметь ориентироваться во множестве вариантов и владеть основами знаний, необходимых при выборе материала для конкретных деталей и изделий. Кроме того, инженер должен знать возможности прогнозирования необходимых свойств используемых материалов и изготавливаемых из них деталей и изделий.
В таких технических отраслях как электротехника и радиоэлектроника качество материалов становится ключом к разработке сложных инженерных решений и созданию новейшей электронной аппаратуры. Применяемые металлические и неметаллические материалы должны обладать особыми физическими свойствами: электрическими, магнитными, тепловыми и т. д. Знание свойств материалов и закономерностей зависимости этих свойств от физической природы, структуры, состава, технологических и эксплуатационных факторов позволяет специалисту не только грамотно выбирать материал при проектировании электротехнических устройств, но и грамотно эксплуатировать их.
|
|
|
СТРОЕНИЕ И СВОЙСТВА МАТЕРИАЛОВ
Классификация материалов
Материал – вещество (совокупность веществ), из которого изготовлено техническое изделие, имеющее функциональное значение.
Конструкционные материалы – материалы, из которых изготавливаются детали машин и конструкций, работающих под нагрузкой.
Материалы классифицируют: по природе – на металлические, неметаллические и композиционные; по технологическому признаку – на деформируемые, литые, свариваемые и др.; по условиям работы – на работающие при низких и высоких температурах, износостойкие и др.; по прочности – на материалы низкой, средней и высокой прочности.
Металлические материалы классифицируют: по основному компоненту сплава – на алюминиевые, медные, никелевые, на железной основе и др.; по типу упрочнения – на закаливаемые, азотируемые и др.; по структурному составу – на одно-, двух- и многофазные. Черные металлы – железо и сплавы (стали, чугуны) с содержанием железа не менее 50 %. Цветные – металлы и их сплавы, имеющие естественную окраску (медь, алюминий, титан и др.). Благородные – золото, серебро, платина и др. Редкоземельные – лантан, неодим, празеодим и др.
Неметаллические материалы подразделяют по изомерному составу и технологическому исполнению (прессованные, тканые, намотанные, формованные и др.), по типам наполнителей (армирующих элементов) и характеру их размещения и ориентации. Пластмассы – материалы на основе высокомолекулярных соединений – полимеров, чаще всего с добавками. Керамические материалы (керамики) – порошки тугоплавких соединений: карбиды, окислы, нитриды, бориды. Керамико-металлические (керметы) – керамика с добавлением металлической связки. Стекла – окислы различных элементов.
Композиционные материалы состоят из металлической или неметаллической матрицы (основы) с заданным распределением упрочнителей и подразделяются на: дисперсноупрочненные – полученные введением в матрицу дисперсных (мелких) частиц; волокнистые – упрочненные непрерывными волокнами и нитевидными кристаллами; слоистые – созданные путем прессования, прокатки разнородных материалов.
|
|
|
Химические связи делятся на ковалентные, ионные, металлические и молекулярные. Ионная связь возникает при полном или частичном обмене валентными электронами, ковалентная – при частичном. Металлическая связь по природе ковалентная, но обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.

 Межатомное взаимодействие. Движущими силами объединения частиц вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Зная характер взаимодействия между атомами, можно прогнозировать свойства материалов. Потенциальная энергия взаимодействия двух атомов зависит от расстояния r между ними и может быть представлена в виде суммы потенциалов притяжения и отталкивания (рис. 1.1). Энергия притяжения в системе ион-электрон является причиной металлической связи и проявляется при всех значениях r. Энергия отталкивания связана с деформацией электронных оболочек ионов и проявляется только на малых расстояниях. Величина r 0 – равновесное расстояние между атомами. Энергию связи E с можно оценить как работу, которую необходимо затратить, чтобы оторвать атом и удалить в бесконечность.
Межатомное взаимодействие. Движущими силами объединения частиц вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Зная характер взаимодействия между атомами, можно прогнозировать свойства материалов. Потенциальная энергия взаимодействия двух атомов зависит от расстояния r между ними и может быть представлена в виде суммы потенциалов притяжения и отталкивания (рис. 1.1). Энергия притяжения в системе ион-электрон является причиной металлической связи и проявляется при всех значениях r. Энергия отталкивания связана с деформацией электронных оболочек ионов и проявляется только на малых расстояниях. Величина r 0 – равновесное расстояние между атомами. Энергию связи E с можно оценить как работу, которую необходимо затратить, чтобы оторвать атом и удалить в бесконечность.
Ковалентная (гомеополярная) связь возникает между нейтральными атомами за счет перекрытия электронных облаков. Обычно осуществляется двумя электронами с противоположно направленными спинами. В пространстве между атомами электроны создают состояния с повышенной электронной плотностью. Отрицательный заряд стремится сблизить ядра атомов. Если электронная плотность распределена симметрично между атомами, то ковалентную связь называют неполярной, смещена в сторону одного из них – полярной. Насыщенность связи – ограниченное число внешних электронов между ядрами образует ограниченное число химических связей. Направленность в пространстве проявляется в одинаковом геометрическом строении близких по составу химических частиц. Особенность связи – поляризуемость. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
|
|
|
Ионная (гетерополярная) связь образуется за счет электростатического взаимодействия противоположно заряженных ионов, которое не зависит от направления. О связи говорят как о ненаправленной и ненасыщенной. В ионных кристаллах не существует отдельных молекул, «молекулой» считается весь кристалл. Энергия связи – несколько электронвольт. Ионные кристаллы, в основном диэлектрики, имеют высокие температуры плавления, прозрачны в широком диапазоне частот. Идеальной ионной связи нет. Полного перехода электронов от одного атома к другому не происходит, они частично остаются в общем пользовании. Например, в кристалле LiF химическая связь на 80 % ионная, на 20 % – ковалентная. Правильно надо говорить о степени ионности (полярности) ковалентной химической связи.
Металлическая связь. В кристаллической решетке металла внешние электроны покидают атомы, превращая их в катионы. Электростатическое взаимодействие обусловлено отталкиванием ионов (электронов) друг от друга и притяжением ионов и электронов. Электроны стремятся приблизить катионы, уравновешивая силы отталкивания. Благодаря свободным электронам металлы хорошо проводят электрический ток и тепло. При нагревании колебания катионов увеличиваются, электронам труднее продвигаться между ними и электрическое сопротивление металла увеличивается. Металлическая связь существует в твердом, расплавленном и аморфном состоянии металлов.
Атомы ионизированы не полностью, часть валентных электронов остается связанной. Появление ионной и ковалентной составляющих связи между соседними атомами обнаружено во многих металлах.
Молекулярная связь. Взаимодействие молекул не приводит к разрыву или образованию новых связей. Отдельные молекулы связаны слабыми ван-дер-ваальсовыми силами. В полярных молекулах центры тяжести положительного и отрицательного зарядов не совпадают и они ориентируются так, чтобы рядом находились концы молекул с противоположными зарядами. Возникает ориентационное взаимодействие – притяжение. Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула поляризуется и становится полярной, молекулы притягиваются слабее, чем в случае полярных молекул. Дисперсионное взаимодействи е возникает между неполярными молекулами. При движении электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы. Неполярная молекула становится полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались, то это привело бы к слиянию. На малых расстояниях электронные оболочки отталкиваются – межмолекулярное отталкивание. Эти же силы удерживают молекулы друг около друга и в жидкостях, поэтому молекулярные кристаллы относительно легко плавятся или даже возгоняются (возгонка – переход вещества из твердого состояния в газообразное, минуя жидкое). Если температура ниже точки плавления или возгонки, то молекулы собираются в упорядоченные каркасы, каждая из которых ориентирована в пространстве определенным образом. Молекулярные кристаллы – это молекулы с насыщенными связями (O2, N2, CO2, H2O), атомы инертных газов (Ar, Ne, Kr, Xe). В электрическом отношении молекулярные кристаллы – диэлектрики.
|
|
|
В реальных кристаллах химические связи в чистом виде встречаются редко: имеет место их наложение. Одна из них преобладает, определяя структуру и свойства твердого тела.
Рождение материала происходит в направлении усложнения структуры (рис. 1.2), отражает определенные уровни его строения
плазма ® газ ® жидкость ® твердое тело
 на каждом этапе сопровождается уменьшением энергии системы, и развивается самопроизвольно. Наибольшим запасом энергии вещество обладает в состоянии плазмы. При разрушении вещества процесс идет в обратном направлении и сопровождается поглощением энергии.
на каждом этапе сопровождается уменьшением энергии системы, и развивается самопроизвольно. Наибольшим запасом энергии вещество обладает в состоянии плазмы. При разрушении вещества процесс идет в обратном направлении и сопровождается поглощением энергии.
Плазма – электрически нейтральный, сильно ионизированный газ, состоящий из положительно заряженных ионов, электронов и нейтральных молекул. Во многих отношениях плазма ведет себя как обычный газ и подчиняется газовым законам. Жидкость не способна сохранять форму, в отличие от газовой среды сохраняет неизменный объем. Подобно газам, жидкости могут течь. Сопротивление течению – вязкость. Вязкость жидкости в 100 раз больше, чем у газов. Твердые тела(аморфные и кристаллические) от других агрегатных состояний вещества отличаются стабильностью формы и размеров. Для них характерно наличие упругих свойств. В жидкостях и аморфных твердых телах упорядоченность в расположении соседних атомов (молекул) наблюдается внутри малых объемов (ближний порядок), в кристаллах – распространяется на большие расстояния (дальний порядок). У аморфных тел (стекло, смола) нет строгого порядка в расположении атомов и молекул. Их можно рассматривать в качестве расплава (жидкой фазы) с очень высокой вязкостью. Они не имеют определенной температуры плавления или кристаллизации, при нагревании постепенно размягчаются до жидкого состояния, что сопровождается плавным снижением вязкости.
Любой материал – сложная физико-химическая система – группа тел, выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Компоненты – минимальное число химически различимых веществ, образующих систему (чистые вещества, химические соединения). Фаза –совокупностьоднородных частей системы, отделенных от других частей поверхностью раздела. Системы, состоящие из одной фазы, называются гомогенными, из нескольких – гетерогенными.
Кристаллическое строение материалов
 В 1848 г. О. Бравэ предположил, что кристаллические решетки кристаллов построены из закономерно расположенных в пространстве точек (узлов), где расположены атомы. Точки периодически повторяются в определенных направлениях через равные промежутки – трансляции (рис. 1.3). Параллелепипед, построенный на трех элементарных некомпланарных (не лежащих в одной плоскости) трансляциях, называют элементарной ячейкой (рис. 1.4). Параметры ячейки: a, b, c – длины векторов трансляций или периоды решетки (для металлов 0,2–0,7 нм) – расстояние между центрами ближайших атомов; a, b, g – углы между векторами (углы, лежащие против осей x, y, z). Координационное число – количество атомов, расположенных на ближайшем одинаковом расстоянии от любого атома. Базис – количество атомов в ячейке (N). Чем выше координационное число и базис, тем больше плотность упаковки – отношение объема, занятого атомами, к объему ячейки:
В 1848 г. О. Бравэ предположил, что кристаллические решетки кристаллов построены из закономерно расположенных в пространстве точек (узлов), где расположены атомы. Точки периодически повторяются в определенных направлениях через равные промежутки – трансляции (рис. 1.3). Параллелепипед, построенный на трех элементарных некомпланарных (не лежащих в одной плоскости) трансляциях, называют элементарной ячейкой (рис. 1.4). Параметры ячейки: a, b, c – длины векторов трансляций или периоды решетки (для металлов 0,2–0,7 нм) – расстояние между центрами ближайших атомов; a, b, g – углы между векторами (углы, лежащие против осей x, y, z). Координационное число – количество атомов, расположенных на ближайшем одинаковом расстоянии от любого атома. Базис – количество атомов в ячейке (N). Чем выше координационное число и базис, тем больше плотность упаковки – отношение объема, занятого атомами, к объему ячейки:
 ,
,
где R – радиус атома; а – параметр решетки.
Кристаллическая решетка является математической абстракцией: кристаллическая структура образуется тогда, когда с каждой точкой решетки одинаковым образом связан базис. Поэтому логично записать:
решетка + базис = кристаллическая структура.
 В зависимости от величин трансляций a, b, c и их ориентации пространственные решетки имеют различную симметрию. Существует 14 решеток Браве, отличающихся кристаллографической симметрией (сингонией) и типом размещения дополнительных атомов (рис. 1.5).
В зависимости от величин трансляций a, b, c и их ориентации пространственные решетки имеют различную симметрию. Существует 14 решеток Браве, отличающихся кристаллографической симметрией (сингонией) и типом размещения дополнительных атомов (рис. 1.5).
В примитивных элементарных ячейках (обозначают символом Р) атомы одного типа находятся только в узлах. Триклинная сингония представляет косоугольный параллелепипед; моноклинная – параллелепипед с одним косым углом; ромбическая – параллелепипед по форме напоминает спичечный коробок; тригональная (символ R) – ромбоэдр – куб, вытянутый (сжатый) вдоль пространственной диагонали; тетрагональная – параллелепипед в виде вытянутого куба; гексагональная – три параллелепипеда с основанием в форме ромба; кубическая – куб.
Кроме того, существует еще 7 типов ячеек, которые содержат атомы не только в узлах, но на гранях и внутри ячейки. Базоцентрированные решетки (обозначают символом С) имеют по дополнительному атому в центрах пары противоположных граней; объемноцентрированные (символ I) – атом в центре ячейки; гранецентрированные (символ F)– атомы в центре каждой грани (рис. 1.5).
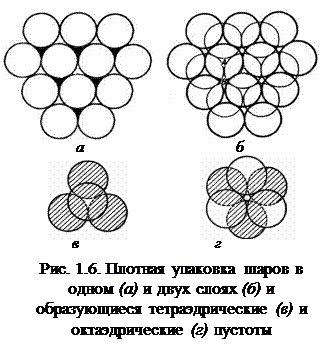 Плотнейшие упаковки. Для устойчивости кристаллической структуры требуется условие минимума ее потенциальной энергии. Каждый атом должен взаимодействовать с возможно большим числом других атомов, т. е. координационное число должно быть максимальным. Реализацию этого условия обеспечивает плотнейшая упаковка, характерная для металлических и ионных структур, кристаллов инертных газов. В этих случаях связи не направлены, атомы (ионы) считают сферическими. Шары касаются друг друга, заполняя большую часть пространства.
Плотнейшие упаковки. Для устойчивости кристаллической структуры требуется условие минимума ее потенциальной энергии. Каждый атом должен взаимодействовать с возможно большим числом других атомов, т. е. координационное число должно быть максимальным. Реализацию этого условия обеспечивает плотнейшая упаковка, характерная для металлических и ионных структур, кристаллов инертных газов. В этих случаях связи не направлены, атомы (ионы) считают сферическими. Шары касаются друг друга, заполняя большую часть пространства.
На рис. 1.6 показан единственный способ плотноупакованного размещения первого слоя шаров в плоскости: каждый шар окружен шестью соседями. Второй слой шаров уложить в каждое углубление между шарами нижнего слоя невозможно. Три шара из нижнего слоя и один из верхнего занимают вершины тетраэдра и образуют тетраэдрическую пустоту. Две тройки шаров из разных слоев занимают вершины октаэдра и образуют сквозную октаэдрическую пустоту. В пустоты могут внедряться атомы соответствующего размера. На втором слое шаров есть два типа пустот – тетраэдрические над шарами первого слоя и октаэдрические над пустотами первого слоя (рис. 1.6, б).
Шары третьего слоя можно уложить двумя способами.
1. Если шары третьего слоя уложены в тетраэдрические пустоты, то третий слой повторяет укладку первого. Слои чередуются как АВАВАВ. Шары четного (нечетного) слоя находятся над шарами четного (нечетного) слоя (рис. 1.7, а). Упаковка – двухслойная,элементарная ячейка – гексагональная, способ упаковки – гексагональная плотнейшая упаковка. Сквозные октаэдрические пустоты продолжаются из ряда в ряд как сплошные каналы, по которым происходит диффузия примесей.
2. Если шары третьего слоя уложены в октаэдрические пустоты (каждый шар третьего слоя находится над пустотами первого), то все три слоя оказываются смещенными друг относительно друга, лишь четвертый слой повторяет первый (см. рис. 1.8, а). Слои чередуются как АВСАВС, где С – третий слой. Над октаэдрической пустотой размещается тетраэдрическая пустота и наоборот; сплошных каналов из пустот нет. Упаковка трехслойная, ячейка – кубическая гранецентрированная, способ упаковки – кубическая плотнейшая упаковка.
Представление о плотнейших упаковках очень полезно при описании структур, образованных атомами разных размеров, – большие атомы образуют плотнейшую упаковку, более мелкие занимают пустоты.
Наиболее распространены следующие кристаллические структуры.
 Гексагональная плотноупакованная решетка. Атомы находятся в вершинах и центрах шестиугольников, центрах боковых граней. Решетку при определенных температурах имеют металлы: a-Ti, Zn, Zr, Mg, Cd, Be. Плотность упаковки – 0,74, координационное число – 12, базис – 6. Для характеристики решетки приняты два параметра – сторона шестигранника а и высота призмы с. Для большинства металлов с/а»1,633. Некоторые металлы (Zn, Cd) имеют менее плотную упаковку атомов: с/а >1,633. Октаэдрические пустоты расположены между тремя атомами базисной плоскости и тремя атомами внутри объема гексагональной призмы (рис. 1.7, б). Тетраэдрические пустоты находятся между тремя атомами базисной плоскости и одним атомом внутри объема гексагональной призмы (рис. 1.7, в).
Гексагональная плотноупакованная решетка. Атомы находятся в вершинах и центрах шестиугольников, центрах боковых граней. Решетку при определенных температурах имеют металлы: a-Ti, Zn, Zr, Mg, Cd, Be. Плотность упаковки – 0,74, координационное число – 12, базис – 6. Для характеристики решетки приняты два параметра – сторона шестигранника а и высота призмы с. Для большинства металлов с/а»1,633. Некоторые металлы (Zn, Cd) имеют менее плотную упаковку атомов: с/а >1,633. Октаэдрические пустоты расположены между тремя атомами базисной плоскости и тремя атомами внутри объема гексагональной призмы (рис. 1.7, б). Тетраэдрические пустоты находятся между тремя атомами базисной плоскости и одним атомом внутри объема гексагональной призмы (рис. 1.7, в).
Гранецентрированная кубическая решетка. Атомы находятся в вершинах куба и центрах каждой грани (см. рис. 1.8). Решетку имеют металлы: g-Fe, Cu, Al, Ni, Au, Ag, Pb и др. Эта решетка – вариант плотнейшей упаковки, при которой каждый шар третьего слоя расположен над пустотами первого слоя: плотность упаковки – 0,74, координационное число – 12, базис – 4. Октаэдрические пустоты (рис. 1.8, б) находятся в центре куба и посредине ребер. Пустоты на ребрах принадлежат одновременно соседним ячейкам, общее их число на ячейку равно четырем. 8 тетраэдрических пустот расположены в центрах тетраэдров на пространственных диагоналях куба на расстоянии одной четверти диагонали от вер  шины (рис. 1.8, в). В тетраэдрическую пустоту можно вписать сферу радиусом 0,22 R, октаэдрическую – 0,41 R, где R – радиус атома в узле решетки (принят за единицу). В октаэдрических пустотах размещаются большие по размеру примесные атомы.
шины (рис. 1.8, в). В тетраэдрическую пустоту можно вписать сферу радиусом 0,22 R, октаэдрическую – 0,41 R, где R – радиус атома в узле решетки (принят за единицу). В октаэдрических пустотах размещаются большие по размеру примесные атомы.
 Объемноцентрированная кубическая решетка. Атомы находятся в вершинах и центре куба на пересечении главных диагоналей (рис. 1.9). Такую решетку имеют металлы: a-Fe, Cr, W, V, Mo, K, Na, Li и др. Решеткане относится к предельно плотной упаковке: плотность упаковки – 0,68, координационное число – 8, базис – 2. Пустоты в ОЦК решетке должны были бы иметь больший размер, чем в ГЦК решетке. Однако наблюдается обратная картина. Октаэдрические пустоты находятся в центре граней куба и посредине его ребер (рис. 1.9, б). Они структурно эквивалентны: атомы в центре объема «одной» ячейки являются атомами в вершинах «другой», смещенной по отношению к первой на половину пространственной диагонали куба. В пустоты можно вписать шар радиусом 0,154 R. Тетраэдрические пустоты располагаются в центре искаженного тетраэдра: два атома на ребре куба и два в центре объема смежных ячеек (рис. 1.9, в). В пустоты можно вписать шар радиусом 0,291 R. В ячейке 12 позиций – по 6 на каждый атом.
Объемноцентрированная кубическая решетка. Атомы находятся в вершинах и центре куба на пересечении главных диагоналей (рис. 1.9). Такую решетку имеют металлы: a-Fe, Cr, W, V, Mo, K, Na, Li и др. Решеткане относится к предельно плотной упаковке: плотность упаковки – 0,68, координационное число – 8, базис – 2. Пустоты в ОЦК решетке должны были бы иметь больший размер, чем в ГЦК решетке. Однако наблюдается обратная картина. Октаэдрические пустоты находятся в центре граней куба и посредине его ребер (рис. 1.9, б). Они структурно эквивалентны: атомы в центре объема «одной» ячейки являются атомами в вершинах «другой», смещенной по отношению к первой на половину пространственной диагонали куба. В пустоты можно вписать шар радиусом 0,154 R. Тетраэдрические пустоты располагаются в центре искаженного тетраэдра: два атома на ребре куба и два в центре объема смежных ячеек (рис. 1.9, в). В пустоты можно вписать шар радиусом 0,291 R. В ячейке 12 позиций – по 6 на каждый атом.
Большая «рыхлость» упаковки ОЦК решетки и более легкое вхождение в нее примесей по сравнению с ГЦК решеткой обусловлены большим числом пустот. На один атом в ОЦК решетке приходятся три октаэдрические и шесть тетраэдрических пустот, в ГЦК – одна октаэдрическая и две тетраэдрические.
Если внедряется атом с размером, превышающим размер пустоты, то он должен раздвинуть соседние атомы. Вокруг тетраэдрической пустоты смещаются четыре атома в направлениях плотной упаковки. Это вызывает значительное перекрытие взаимно отталкивающихся электронных облаков. Вокруг октаэдрической пустоты смещаются два атома вдоль ребра куба, т. е. вдоль направления с малой плотностью упаковки атомов. Поэтому примесные атомы в ОЦК решетке размещаются в меньших по размеру октаэдрических пустотах. Так, например, внедряются атомы углерода в решетку a-Fe.
Полиморфизм. Некоторые металлы (железо, кобальт, марганец, теллур, титан, цирконий, уран) и химические соединения при изменении температуры или давления могут существовать в разных кристаллографических формах.
Увеличение гидростатического (всестороннего) давления вынуждает атомы сближаться. При достижении критического значения давления происходит структурный фазовый переход. Кристаллическая ОЦК решетка при большом давлении должна быть ГЦК или ГПУ решеткой. Изменение координационного числа сопровождается значительным увеличением плотности упаковки, т. е. уменьшением объема.
Когда тип химической связи при полиморфном превращении не изменяется, то оно не приводит к значительным изменениям объема. Как показали дилатометрические измерения, при переходе γ-Fe→a-Fe объем увеличивается на 0,8 %. Когда превращение сопровождается изменением типа связи между атомами, то оно приводит к значительным изменениям объема. Белое олово с тетрагональной решеткой и металлической связью ниже 13,2 °С превращается в серое олово с искаженной кубической решеткой, подобной алмазу, и свойствами полупроводника (ширина запрещенной зоны 0,08 эВ). Превращение сопровождается увеличением объема на 26 %, олово разрушается, рассыпаясь в серый порошок («оловянная чума»). Скорость превращения достигает максимального значения (0,004 мм/ч) при минус 32 °С.
Полиморфизм распространен среди металлов переходных групп, лантаноидов и актиноидов. Склонность к полиморфизму обусловлена близостью энергетических уровней электронов и легкостью их перехода с одних уровней на другие при изменении температуры. Такие переходы приводят к изменению концентрации электронного газа и заряда ионов, что требует изменения расположения атомов в пространстве, т. е. структуры кристалла.
Некоторые металлы (марганец, уран, плутоний), химические соединения при низких температурах являются хрупкими из-за наличия направленной ковалентной связи. При повышении температуры эти связи разрушаются, металлы переходят в металлические модификации. Общая закономерность: с повышением температуры наблюдаются переходы от ковалентных или ковалентно-металлических структур к металлическим, но не наоборот.
Кристаллографические символы. Плотность упаковки атомов в разных плоскостях и по разным направлениям неодинаковая. Свойства кристалла в разных направлениях неодинаковы – явление анизотропии. Чтобы понять это явление, необходимо обозначить плоскости и направления в кристалле с помощью индексов Миллера. Чтобы установить индексы, элементарную ячейку кристалла вписывают в пространственную систему координат (см. рис. 1.10). Оси координат x, y, z называются кристаллографическими осями. За единицу измерения вдоль каждой оси принимается период решетки, т. е. длина ребер элементарной ячейки.
Индексы кристаллографических плоскостей. Чтобы найти индексы плоскости простой кубической решетки, нужно: 1) установить координаты точек пересечения плоскости с осями координат, измеренные в постоянных решетки а, в, с; 2) взять обратные значения этих чисел; 3) привести их к общему знаменателю; 4) отбросить общие знаменатели и заключить в скобки числители этих дробей, переписанные по порядку. Это и будут индексы Миллера (hkl).
Пример. Плоскость отсекает на осях координат (x, y, z) отрезки 1, 1/2, 1/3 (рис. 1.10). Обратные величины: 1, 2, 3. Это целые числа. Символ плоскости – (123). Следует читать «один, два, три».
Параллельные плоскости имеют одинаковые индексы. Если плоскость пересекает ось в области отрицательных значений координат, то соответствующий индекс будет отрицательным, знак минус ставится над индексом. Плоскость, параллельная какой-либо координатной оси, имеет по этой оси индекс нуль, так как 1/∞ = 0.
Зная индексы (hkl) плоскости, можно подсчитать межплоскостное расстояние d между плоскостями данного семейства для кубических кристаллов с периодом решетки a по формуле
 .
.
 Индексы кристаллографических направлений представляют три наименьших целых числа, характеризующих положение ближайшего узла, лежащего на данном направлении (рис. 1.10). Ориентация прямой определяется координатами двух точек. Одна точка совпадает с началом координат, координаты второй устанавливаются в единицах периода решетки. Далее остается привести отношения этих координат к отношению трех наименьших целых чисел (обратные величины при вычислении не рассматриваются). Заключив полученные числа в квадратные скобки, получим индексы кристаллографического направления.
Индексы кристаллографических направлений представляют три наименьших целых числа, характеризующих положение ближайшего узла, лежащего на данном направлении (рис. 1.10). Ориентация прямой определяется координатами двух точек. Одна точка совпадает с началом координат, координаты второй устанавливаются в единицах периода решетки. Далее остается привести отношения этих координат к отношению трех наименьших целых чисел (обратные величины при вычислении не рассматриваются). Заключив полученные числа в квадратные скобки, получим индексы кристаллографического направления.
Для гексагональной решетки удобно пользоваться четырьмя символами. Вводится дополнительно координатная ось u, которая с осями x и y составляет угол 120 ° (рис. 1.10). Символы плоскостей находятся через обратные величины отрезков, отсекаемых плоскостью на осях координат. Плоскость обозначается символами (hkil), где i – дополнительный индекс. При этом должно выполняться соотношение: h + k + i = 0. На рис. 1.10 показаны базисная (0001) и призматическая ( ) плоскости, а также направления вдоль координатных осей.
) плоскости, а также направления вдоль координатных осей.
|
|
|


