 |
Клиническая характеристика метода
|
|
|
|
По мере освоения метода наметились две главные тенденции. Во-первых, круг активно используемых показателей сократился с полутора десятков до двух — СИ и ОПСС. Эти величины имеют ясный физиологический смысл, однозначную трактовку, являются надежными индикаторами гемодинамического благополучия и удобны для избирательного управления. Наглядность управления производительностью сердца и тонусом сосудов в значительной мере способствовала росту доверия к методу у нас и врачей базовых отделений. Во-вторых, изменился стереотип тактических решений: место традиционного "управления по АД" постепенно заняло управление по СИ. Это объяснялось большей гемодинамической значимостью МОК по сравнению с АД и большей, по нашему опыту, специфичностью гипердинамии в качестве маркера ноцицептивной реакции по сравнению с гипертензией. Изначально предполагалось наличие в расчетах СИ методической ошибки, знак и модуль которой в каждом случае неизвестны. Полагая эту ошибку линейной, мы приняли за правило всегда оценивать текущие величины СИ и ОПСС не только в абсолютных цифрах, на и по отношению (в %) к исходным. Важнейшая задача мониторинга — своевременная сигнализация об осложнениях и критических инцидентах. В нашем архиве наиболее значимые осложнения были представлены двумя массивными кровотечениями и десятью случаями острой циркуляторной недостаточности иного генеза — кардиогенного, анафилактического, токсического и нейрогенного (спинальная, эпидуральная и комбинированная анестезия). У одной больной имело место необычное сочетание последовательно развившихся анафилактического и геморрагического шоков. По сравнению с мониторингом АД и пульсоксиметрией реомониторинг редко давал выигрыш в быстроте распознавания гемодинамических расстройств, на зато позволял
|
|
|
а) с самого начала однозначно трактовать их патогенез и
б) в ряде случаев улавливать тенденцию нарастания тех или иных сдвигов до выхода АД и данных пульсоксиметрии из коридора допустимых значений.
Немедленный диагноз поврежденного звена (СИ или ОПСС) в конечном счете экономил время, а последующий контроль динамики объективизировал коррекцию. В качестве иллюстраций приведем клинические примеры.
Пациентка Б., 43 лет, поступила в ЦМСЧ №122 31 марта 1998 г. Незадолго до этого компьютерная томография подтвердила наличие у нее феохромоцитомы правого надпочечника. В течение 5 лет она страдала типичными кратковременными кризами с подъемом АД до 280/200 мм рт.ст. при рабочем уровне 130/80 мм рт.ст. При обследовании диагноз был подтвержден резким повышением уровней экскреции с мочой катехоламинов и ванилилминдальной кислоты. Выявлены небольшая протеинурия, нарушения внутрипредсердной и внутрижелудочковой проводимости, умеренное снижение сократительной функции ЛЖ (ФВ 59%) на фоне его гипертрофии. Из сопутствующих заболеваний отмечены двухсторонний нефроптоз и ожирение с избытком массы тела 46%. Больная оперирована 7 апреля открытым способом (доц. Л.М. Краснов) после пятидневного курса феноксибензамина (по 1 5 мг в сутки). Как видно из анестезиологической карты, приведенной на рис. 8, вначале использовалась принятая в клинике при адреналэктомиях как стандарт клофелин-фентаниловая аналгезия. Для коррекции гипертензии применили инфузию нитроглицерина, на фоне которой начальный этап операции и анестезии протекал без особенностей.
Однако далее возникла нестандартная ситуация. Выявленная при ревизии опухоль диаметром 12 см оказалась плотно сращенной с печенью и нижней полой веной. В результате мобилизация проходила с большими техническими трудностями, а при удалении препарата возник дефект стенки нижней полой вены протяженностью полтора сантиметра. Непрерывным атравматическим швом он был зашит, однако суммарный объем кровопотери составил по ретроспективной оценке около 3 л. Кровь была частично реинфузирована с использованием гепариновой стабилизации, выполнены массивная гемотрансфузия и быстрая плазмозамещающая терапия. Однако на определенном отрезке времени темп потери все же превосходил скорость ее восполнения, и из графика сердечного выброса (кривая в нижней части карты) видно постепенное развитие гиповолемического шока с максимальным падением СИ до 1,5 л•м-2•мин-1. Пик гипотензии составил при этом 60/50 мм рт.ст.; в течение нескольких минут монитор "Sirecust-1260" не позволял неинвазивно определять АД. В момент, когда на высоте гиповолемии перестал определяться и сигнал пульсоксиметра, возможность визуально и численно оценивать гемодинамику давал нам только реомонитор.
|
|
|
АНЕСТЕЗИОЛОГИЧЕСКАЯ КАРТА

Рисунок 8.
Форсированием объемной инфузии, подключением инфузии дофамина, а затем и окончательным хирургическим гемостазом удалось постепенно стабилизировать производительность сердца. Однако низкое ОПСС, возможно, связанное как с последствиями тканевой ишемии, так и с "синдромом отмены" избыточной секреции катехоламинов, поддерживало артериальную гипотензию. Оперативно ориентироваться в этой непростой ситуации, наращивая темп инфузии дофамина до высокого прессорного, позволял только мониторинг МОК.
В конце операции была отмечена выраженная коагулопатия — кровь больной не свертывалась в течение 20 мин. Мы связали ее, главным образом, с гепаринизацией реинфузированной крови, и введение 100 мг сульфата протамина привело к быстрой стабилизации времени Lee-White на уровне 4-5 мин.
Послеоперационный период протекал на удивление гладко. Через 3,5 ч после окончания анестезии выполнена экстубация, на следующие сутки прекращена инфузия дофамина, а на третьи сутки после операции стал возможен перевод в общую палату. Через 13 дней после операции больная выписана с выздоровлением.
|
|
|
Таким образом, нестандартный характер ситуации в данном наблюдении был обусловлен сочетанием гиповолемического и вазопериферического механизмов острой недостаточности кровообращения. Целенаправленность терапии в этих условиях могла быть обеспечена только непосредственным мониторингом величин МОК и ОПСС. В другом, не менее необычном, случае исход оказался неблагоприятным. Больная В., 58 лет, жительница Азербайджана, поступила в ЦМСЧ № 122 12 августа 1998 г. с диагнозом эхинококковой кисты печени. Ранее, в марте того же года в Баку была предпринята неудачная попытка резецировать кисту. В нескольких клиниках нашего города воздержались от попыток удаления кисты, расположенной в технически труднодоступной зоне у задней кромки нижней поверхности печени и вызывавшей у больной резкий болевой синдром. Сопутствующая патология ограничивалась II стадией гипертонической болезни.
АНЕСТЕЗИОЛОГИЧЕСКАЯ КАРТА

Рисунок 9.
При операции, выполненной 17 августа (д.м.н. В.Н. Горбачев), выявлена эхинококковая киста печени, при попытке резекции которой произошло нарушение ее целостности. В течение ближайших 2 минут произошло резкое падение системного сосудистого тонуса, сопровождавшееся снижением МОК, что привело к субкритической артериальной гипотензии. Как видно из анестезиологической карты, представленной на рис. 9, снижение ОПСС, СИ и АД составило при этом, соответственно, 70, 20 и 76% исходных величин. Ситуация была расценена как анафилактический шок, вызванный резорбцией с поверхности брюшины разрешающей дозы антигенов паразита. Проведена стандартная терапия введением селективного а -адреномиметика (мезатон) и форсированием инфузии; ограничение на использование адреналина накладывала предшествующая ингаляция паров фторотана. Наметилась тенденция к стабилизации гемодинамики, однако остановить операцию в этот момент уже не представлялось возможным из-за незавершенного выделения оболочек кисты из паренхимы печени. При дальнейшей мобилизации развилось массивное кровотечение, вновь приведшее к снижению СИ с повторным падением АД. После резекции кисты, хирургического гемостаза и дренирования брюшной полости операция завершена. Однако массивное кровотечение по дренажам (темп более 1л /ч)и отсутствие стабилизации гемодинамики, несмотря на массивную инфузию, заставили в течение ближайшего часа произвести релапаротомию. В брюшной полости — кровь со сгустками; при ревизии в зоне операции выявлен линейный дефект стенки нижней полой вены длиной 5-6 мм, явившийся источником продолжающегося кровотечения. Дефект зашит, брюшная полость промыта, лапаротомная рана зашита. Во время повторной операции имел место эпизод остановки кровообращения в виде электромеханической диссоциации; выполнен прямой массаж сердца. Несмотря на массивную инфузию и гемотрансфузию, введение высоких доз глюкокортикоидов, катехоламиновую поддержку, коррекцию КОС, гемодинамику стабилизировать не удалось и при нарастающем падении СИ наступила повторная остановка кровообращения по типу рефракторной брадикардии с исходом в асистолию. Через 8 часов после начала первой операции констатирована биологическая смерть больной.
|
|
|
В этом наблюдении мы столкнулись с необычным сочетанием: на фоне имевшегося у больной анафилактического шока, обусловленного антигенами Echinococcus granulosus, развился тяжелый геморрагический шок. И хотя мощность агрессии явно превышала возможности компенсации и управления, и в этом случае именно реомониторинг обеспечил обоснованный анализ гемодинамической ситуации.
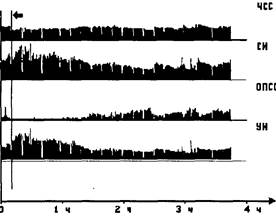
Рисунок 10.
Непосредственный документальный результат интраоперационного мониторинга иллюстрирует рис. 10. В качестве примера представлен гемодинамический протокол операции — передней резекции прямой кишки у больной М., 52 лет, выполненной под комбинированной (эпидуральная в сочетании с облегченной общей) анестезией. Вертикальной чертой, на которую указывает черная стрелка вверху, отмечен самый характерный момент гемодинамической картины регионарной анестезии — резкий подъем СИ, компенсирующий возникающее в результате блока падение ОПСС. При этом сопоставление графиков СИ и ОПСС показывает, что пик гипердинамической реакции кровообращения несколько отстает от момента падения системного сосудистого тонуса. Этот случай интересен тем, что гипердинамия развивалась исключительно за счет роста УОК, тогда как ЧСС снизилась. Видны также следы присутствия отдельных артефактов — резкие "всплески" на графиках динамики показателей и краткие перерывы в записи.
Таким образом, реографический мониторинг проявил себя достаточно информативным и, что не менее важно, наглядным методом контроля гемодинамики во время анестезии. Возможность идентификации патогенетического механизма циркуляторной недостаточности в момент его появления (нередко до развития общедоступных клинических симптомов) является главным преимуществом метода перед традиционными видами мониторинга кровообращения.
|
|
|


