 |
19. Классификации карбоновых кислот по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
|
|
|
|
19. КЛАССИФИКАЦИИ КАРБОНОВЫХ КИСЛОТ ПО ОСНОВНОСТИ, НАСЫЩЕННОСТИ, НАЛИЧИЮ ФУНКЦИОНАЛЬНОЙ ГРУППЫ, ЧИСЛУ АТОМОВ УГЛЕРОДА В ЦЕПИ.

В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH. По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.

20. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ С УЧАСТИЕМ КАРБОКСИЛЬНОЙ ГРУППЫ: ДЕКАРБОКСИЛИРОВАНИЕ, ОБРАЗОВАНИЕ СОЛЕЙ, АМИДОВ, АНГИДРИДОВ, ГАЛОГЕНГИДРИДОВ, СЛОЖНЫХ ЭФИРОВ.
В отличие от спиртов и фенолов, карбоновые кислоты обладают заметной кислотностью, хотя и значительно уступают по силе минеральным кислотам, таким, как фосфорная или соляная. Поскольку кислотность напрямую связана с легкостью отщепления протона, сила кислоты увеличивается, если отрицательный заряд аниона лучше компенсируется отрицательными индуктивными или мезомерными эффектами
Получение ангидридов кислот. Ангидриды кислот можно рассматривать как продукты дегидратации двух молекул кислоты. При отнятии воды от карбоновых кислот (которое удается осуществить только при помощи фосфорного ангидрида Р2О5) можно получать смешанные и моноангидриды: 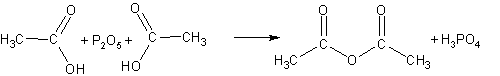
Другой способ получения ангидридов- реакция солей карбоновых кислот с галогенангидридами кислот:
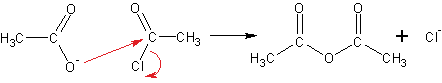
Уксусный ангидрид- жидкость, кипящая при 140 оС, обладающая неприятным резким запахом. Ангидрида муравьиной кислоты не существует.
Образование амидов
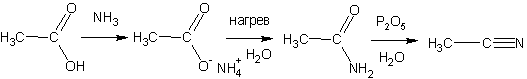
Получение галогенангидридов кислот
Хлорангидриды кислот получают классическими реакциями замены гидроксильной группы на галоген (так же, как и в случае со спиртами):
|
|
|
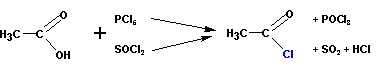
Или при реакции соли карбоновой кислоты с хлористым сульфурилом:

Получение сложных эфиров
Этерификация кислот спиртами приводит к сложным эфирам с переменным успехом.
Реакция протекает в кислой среде и обратима. Роль кислоты заключается в активации (усилении реакционной способности) карбоновой кислоты (но не спирта! ) путем протонирования:
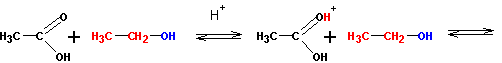
Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
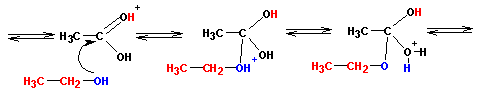
Реакция завершается переносом протона, отщеплением воды и, наконец, отщеплением самого протона (регенерация катализатора):
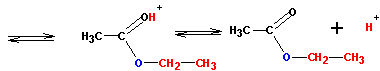
Поскольку все стадии этерификации обратимы, для увеличения выхода приходится отгонять из реакционной смеси продукт (эфир) или связывать воду. Обратите внимание, что в составе сложного эфира присутствует атом кислорода от спирта, а не от кислоты. Успех реакции в значительной степени зависит от строения спирта и кислоты. Так, наиболее успешно реакция протекает с короткими молекулами спиртов и кислот. Важное значение имеет то, чтобы ни спирт, ни кислота не были стерически затруднены у реакционных центров (гидроксильной и карбоксильной групп). Скорость реакции этерификации кислот спиртами растет с понижением значения рН до определенной величины, а с дальнейшим снижением рН опять падает. Связано это со все возрастающей степенью протонирования (по атому кислорода) молекулы спирта и, соответственно, потерей ей реакционной способности (атаковать карбонильный углерод).
Другим удобным способом получения сложных эфиров является реакция солей карбоновых кислот с галоидными алкилами:

При наличии ангидридов и галогенангидридов кислот наиболее удобно получать эфиры из них, так как эти реакции идут практически полностью (и необратимо). С галогенангидридами спирты реагируют по схеме:
|
|
|
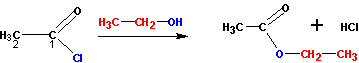
С ангидридами реакции идут немного менее активно, но гораздо лучше, чем с самими кислотами. В реакцию берут спирт и ангидрид кислоты:
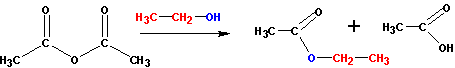
|
|
|


