 |
5. Ассимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности. Оптическая активность.
|
|
|
|
5. АССИММЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА КАК ЦЕНТР ХИРАЛЬНОСТИ. СТЕРЕОИЗОМЕРИЯ МОЛЕКУЛ С ОДНИМ ЦЕНТРОМ ХИРАЛЬНОСТИ. ОПТИЧЕСКАЯ АКТИВНОСТЬ.
Хиральный центр -это атом в молекуле, замещенный таким образом, что он становится несовместимым со своим зеркальным отражением. Атом углерода является центром хиральности только в том случае, когда имеет четыре различных заместителя.
Энантиомеры способны вращать плоскость поляризации света, т. е. обладают оптической активностью
Типичным примером пары энантиомеров с 1 центром хиральности является 2-гидроксипропановая кислота – CH3-*CHOH-COOH. В молекуле этого соединения содержится 1 асимметрический атом углерода.
6. ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА. АБСОЛЮТНАЯ КОНФИГУРАЦИЯ СТЕРЕОИЗОМЕРОВ. D/L
СТЕРЕОХИМИЧЕСКИЕ РЯДЫ.
Для изображения конфигурационных изомеров на плоскости можно пользоваться стереохимическими формулами. Однако удобнее применять более простые в написании проекционные формулы Фишера (проще - проекции Фишера). Рассмотрим их построение на примере молочной (2-гидроксипропановой) кислоты.
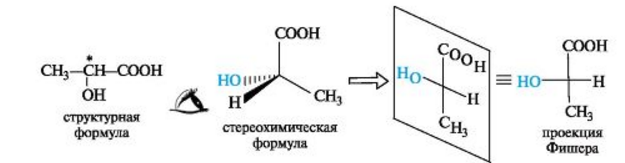
D. L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α -аминокислоты, α -гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой L. Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой D. Отнесение к D- или L-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- или L-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у l-глицеринового альдегида, поэтому энантиомер (I) относят к L-ряду. Из тех же соображений энантиомер (II) относят к D-ряду. Так из сравнения проекций Фишера определяют относительную конфигурацию.
|
|
|
Установление абсолютной конфигурации стало возможным только благодаря развитию физико-химических методов, особенно рентгеноструктурного анализа, с помощью которого в 1951 г. впервые была определена абсолютная конфигурация хиральной молекулы.
7. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА. ТИПЫ ГИБРИДИЗАЦИЙ АТОМНЫХ ОРБИТАЛЕЙ.
8. СОПРЯЖЕННЫЕ СИСТЕМЫ С ОТКРЫТОЙ И ЗАМКНУТОЙ ЦЕПЬЮ НА ПРИМЕРАХ БУТАДИЕНТА 1, 3 И БЕНЗОЛА.
Углерод, входящий в состав органических соединений, проявляет постоянную валентность. На последнем энергетическом уровне атома углерода содержится 4 электрона, два из которых занимают 2s-орбитали, имеющие гантелеподобную форму. При возбуждении один электрон из 2s-орбитали может переходить на одну из вакантных 2р-орбитали. Этот переход требует некоторых энерго. затрат. В результате возбужденный атом углерода имеет 4 неспаренных электрона и его электронная конфигурация выражается формулой 2s12р3.
Типы гибридизации:
sр3-гибридизация (первое валентное состояние углерода): химические связи образуют альфа связи (сигма-связи), форма молекулы в пространстве- тетраэдр.
sр2-гибридизация (второе валентное состояние углерода): присутствует двойная связь
sр-гибридизация (третье валентное состояние углерода): присутствует тройная связь
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р –орбиталей.
|
|
|
Пи, пи-сопряжение: Деколализованные молекулярные облака принадлежат двум или более пи-связям.
Условия пи, пи-сопряжения:
• кратные связи должны быть разделены ОДНОЙ простой связью
• Максимальное сопряжение достигается, когда обе кратные связи лежат в одной плоскости
• Если по пространственным соображениям две кратные связи не могут лежать в одной плоскости, то сопряжение между ними уменьшается с увеличением угла между плоскостями этих связей
р, пи-сопряжение: сопряжение пи-связи и соседней р-орбитали, содержащей пару электронов: С=С-•Х•
Условия р, пи-сопряжения:
• Атом, несущий свободную электронную пару должен быть отделен от кратной связи одной простой связью
• Наибольшей величины сопряжение достигает, если р-атомное облако перпендикулярно плоскости двойной связи
• Сопряжение невозможно, если р-атомное облако лежит в плоскости двойной связи
• Участие атома С в р, пи-сопряжении с кратной связью возможно только в том случае, еси он превратится в радикал, катион или анион
Сопряжение с открытой цепью (бутадиен):
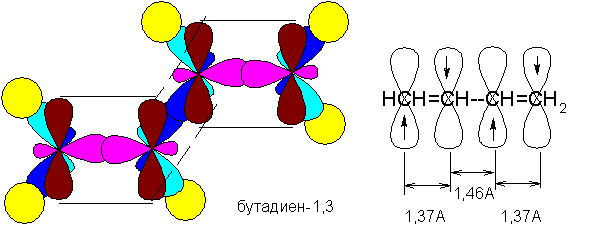
СН2=СН-СН=СН2
Сопряжение с открытой цепью (бензол): 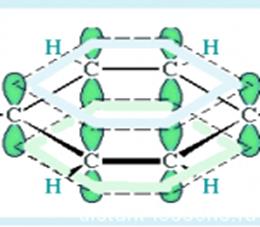 C6H6
C6H6
|
|
|


