 |
А) объединенное уравнение 1-го и 2-го начал для открытых систем в форме обобщенного соотношения Гиббса: (1)
|
|
|
|
Вопрос 27
1. 
2. 
объединяющее первое и второе начала термодинамики (2) для обратимых процессов:
Это уравнение называют фундаментальным уравнением, а функцию U, выражаемую
через S, V и n, называют характеристической функцией естественных переменных S, V и
n.
Функция называется характеристической, если все
термодинамические свойства гомогенной системы могут быть выражены в явном виде
через нее и ее частные производные по естественным переменным.
Пример: естественными переменными внутренней энергии закрытой системы
являются энтропия и объем. Так как U – функция состояния, то dU является
полным дифференциалом и, согласно (4.1), температуру и давление можно
выразить как

Для расчета термодинамических свойств, не входящих непосредственно в
фундаментальное уравнение, используют условие равенства смешанных
производных и некоторые другие математические соотношения.
Та же внутренняя энергия, выраженная через другие переменные, уже не
будет являться характеристической. Например, если рассматривать
внутреннюю энергию U как функцию объема и температуры, а не объема и
энтропии, то также можно записать выражение для полного дифференциала:
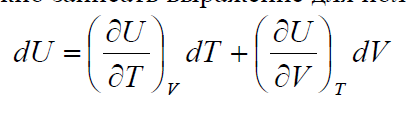
б) Хими́ческий потенциа́л  — один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
— один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:

где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала  , также давление P и температуру T.
, также давление P и температуру T.
Можно доказать, что химический потенциал задаётся формулой
 ,
,
где  — потенциал Гиббса.
— потенциал Гиббса.
|
|
|
Если энергия системы зависит не от объёма, а от других термодинамических параметров  , исходная формула принимает вид
, исходная формула принимает вид
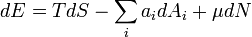
Если в системе имеется несколько разных типов частиц, есть столько же разных химических потенциалов.
Функции H (p,S), F (V,T), G (p,T), выраженные через естественные переменные, так
же как и U (S, V), называют характеристическими функциями или термодинамическими
потенциалами. Если рассматриваются открытые системы или системы, в которых
происходят химические реакции, то в качестве дополнительных независимых переменных
надо использовать количества составляющих веществ nj, которые могут быть выражены
через количества компонентов ni. Это приведет к появлению в уравнениях дополнительного слагаемого 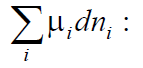




в) Открытые системы могут обмениваться с окружающей средой энергией и веществом. Например, водный раствор хлорида натрия, находящийся в открытом сосуде. При испарении воды из раствора и при теплообмене будут меняться масса системы и ее температура, а, следовательно, и энергия.
Закрытые системы не обмениваются с окружающей средой веществом. Например, раствор хлорида натрия в закрытом сосуде. Если раствор и окружающая среда имеют разную температуру, то будет происходить нагревание или охлаждение раствора, а, следовательно, будет меняться его энергия.
Изолированные системы не могут обмениваться со средой ни веществом, ни энергией. Изолированная система – это идеализация. В природе таких систем нет. Но, несмотря на невозможность практического воплощения, изолированные системы позволяют определять максимальные теоретические разности энергий между системой и ее окружением.
Самопроизвольные процессы (естественные или положительные) протекают в системе без вмешательства со стороны внешней среды и сопровождаются уменьшением внутренней энергии системы и передачей энергии в окружающую среду в форме теплоты и работы. Эндотермические самопроизвольные процессы не противоречат этому определению, так как они могут протекать в неизолированной системе и производить работу за счет теплоты окружающей среды.
|
|
|
Судить о возможности самопроизвольного протекания процесса можно по знаку изменения функции свободной энергии: если в процессе взаимодействия происходит уменьшение свободной энергии, то процесс термодинамически возможен. Если ДС 0, то протекание процесса невозможно. Таким образом, все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии. Эта формулировка справедлива как для изолированных, так и для открытых систем.
В О. с. возможны стационарные состояния с постоянным производством энтропии, которая должна при этом отводиться от системы. Такое стационарное состояние характеризуется постоянством скоростей химических реакций и переноса реагирующих веществ и энергии. При таком «проточном равновесии» производство энтропии в О. с. минимально (Пригожина теорема). Стационарное неравновесное состояние играет в термодинамике О. с. такую же роль, какую играет термодинамическое равновесие для изолированных систем в термодинамике равновесных процессов. Энтропия О с. в этом состоянии удерживается постоянной, т.к. её производство компенсируется отводом от системы, но это стационарное значение энтропии не соответствует её максимуму, как в изолированной системе.
Наиболее интересные свойства О. с. выявляются при нелинейных процессах. При таких процессах в О. с. возможно осуществление термодинамически устойчивых неравновесных (в частном случае стационарных) состояний, далёких от состояния термодинамического равновесия и характеризующихся определённой пространственной или временной упорядоченностью (структурой), которую называют диссипативной, т.к. её существование требует непрерывного обмена веществом и энергией с окружающей средой. Нелинейные процессы в О. с. и возможность образований структур исследуются на основе уравнений кинетики химической (См. Кинетика химическая); баланса скоростей химических реакций в системе со скоростями подачи реагирующих веществ и отвода продуктов реакции. Накопление в О. с. активных продуктов реакций или теплоты может привести к автоколебательному (самоподдерживающемуся) режиму реакций. Для этого необходимо, чтобы в системе реализовалась положительная Обратная связь: ускорение реакций под воздействием либо её продукта (химический автокатализ), либо теплоты, выделяющейся при реакции. Подобно тому, как в колебательном контуре с положительной обратной связью возникают устойчивые саморегулирующиеся незатухающие колебания (автоколебания), в химической О. с. с положительной обратной связью возникают незатухающие саморегулирующиеся химические реакции. Автокаталитические реакции могут привести к неустойчивости химических процессов в однородной среде и к появлению у О. с. стационарных состояний с упорядоченным пространственным неоднородным распределением концентраций (диссипативных структур с упорядоченностью на макроскопическом уровне). Характер структур определяется конкретным типом химических реакций. В О. с. возможны также концентрационные волны сложного нелинейного характера.
|
|
|
Теория О. с. важна для понимания физико-химических процессов, лежащих в основе жизни, т.к. живой организм представляет собой устойчивую саморегулирующуюся О. с., обладающую высокой организацией как на молекулярном, так и на макроскопическом уровне. Подход к живым системам как к О. с., в которых протекают нелинейные химические реакции, открывает новые возможности для исследования процессов молекулярной самоорганизации на ранних этапах возникновения жизни.
Вопрос 34
ПОВЕРХНОСТЬ РАЗДЕЛА ФАЗ – это граничная поверхность между различными фазами вещества.
Свободная поверхностная энергия существует на границах разделах любых фаз. В пористой среде, где одновременно могут находиться несколько фаз, например вода, нефть и газ, и при наличии твердой поверхности межфазные границы могут иметь сложную форму. Это связано с тем, что, в частности, и на границе жидкость - твердое тело, газ-твердое тело также существует свободная поверхностная энергия. Предположим, что имеется три фазы: жидкость, газ и твердое тело. Обозначим поверхностное натяжение на границе жидкость - газ через о, на границах твердое тело - жидкость и твердое тело - газ соответственно через атж и сттг. Свободная энергия системы складывается из поверхностной энергии всех границ раздела.
|
|
|
Свободная поверхностная энергия, рассчитанная на 1 см2 поверхности раздела, называется поверхностным натяжением и измеряется в эрг / см2 или дин / см. Величина его зависит от природы обеих фаз, соприкасающихся друг с другом и образующих поверхность раздела и определяется различием в интенсивности межмолекулярных сил, действующих в каждой фазе или различием в их полярности
Свободная поверхностная энергия у мельчайших почвенных частиц делает их способными поглощать из растворов и газов молекулы некоторых веществ. Это можно продемонстрировать простым опытом: взять какой-нибудь окрашенный раствор, например отвар чешуек лука, и профильтровать его через почву на воронке; раствор обесцветится, так как молекулы органического красящего вещества хорошо поглощаются почвой. Разумеется, почва поглощает и молекулы бесцветных органических веществ, но в этом можно убедиться, лишь проделав специальные анализы раствора до и после прохождения его через почву.
Свободная поверхностная энергия является не всей энергией, которая затрачивается при образовании новой поверхности. Этот процесс мсжет быть осуществлен изотермически, в виде затраты тепла.
Свободная поверхностная энергия численно равна механи - [ ческой работе системы в изотермических условиях. Так как рассматриваемая система термодинамически неэав-ноьесна, то изменения микросостояния в первую очередь воз - 1никают па контактных поверхностях под влиянием природы самой поверхности и сил гравитации, приложенных в данном месте.
Свободная поверхностная энергия всей системы равна F S f, где S - межфазная поверхность; f - удельная свободная поверхностная энергия. При образовании агрегатов без непосредственного контакта твердых частиц граница раздела фаз не уменьшается.
Свободная поверхностная энергия является мерой работы, затрачиваемой на образование единицы поверхности. Эта величина не может быть определена непосредственно, как в жидкостях, у которых поверхностная энергия и поверхностное натяжение численно совпадают.
Свободная поверхностная энергия проявляется не только на границе твердое тело - газ, но и границе твердое тело - жидкость. Практически представляют наибольший интерес те случаи, когда твердое тело граничит не с чистой жидкостью, а с раствором. В этих случаях адсорбируются как растворенное вещество, так и растворитель. Если растворенное вещество адсорбируется сильнее растворителя, происходит положительная адсорбция этого вещества. Если же, наоборот, растворитель поглощается твердым телом сильнее растворенного вещества, мы имеем отрицательную адсорбцию вещества. Отрицательная адсорбция обнаруживается в концентрированных растворах, где концентрация растворенного вещества приближается к концентрации растворителя. При таком соотношении концентраций преобладающая адсорбция растворителя приводит к тому, что его концентрация в растворе уменьшается, а концентрация растворенного вещества увеличивается. Таким образом отрицательная адсорбция характеризуется увеличением концентрации растворенного вещества в объеме раствора, в то время как при положительной адсорбции концентрация растворенного вещества в объеме уменьшается.
|
|
|
Свободная поверхностная энергия на границе кристалл - расплав, отнесенная к одному поверхностному атому по некоторым данным, принимается равной половине скрытой теплоты плавления, также отнесенной к одному атому. Учитывая ретикулярную плотность различных граней, можно построить шкалу относительных свободных энергий граней с малыми индексами и принять, что относительные скорости образования двумерных зародышей на этих гранях обратно пропорциональны размерам таких скоплений атомов, которые позволяют осуществить насыщение половины свободных связей на этих поверхностях.
Свободная поверхностная энергия F профилей / - 3 различна и в первом приближении может считаться пропорциональной aS, где S - площадь поверхности жидкости. При образовании пологого профиля (кривая 2) значения 5 и, следовательно, F уменьшаются по сравнению с профилем 1 без переходной зоны. Это эквивалентно действию отрицательного линейного натяжения на линии трехфазного контакта. По этой причине теории, использующие для расчетов профиля переходной зоны уравнение (4), могут давать только отрицательные значения линейного натяжения. [11]
Свободная поверхностная энергия границы раздела двух твердых фаз в общем случае состоит из двух слагаемых, обусловленных одно - несогласованностью химических связей, а другое - упругими напряжениями при слиянии разнородных кристаллических поверхностей.
Если свободная поверхностная энергия на границе твердое тело - газ имеет большее значение, чем на границе твердое тело - жидкость, то твердое тело будет смачиваться этой жидкостью.
Поэтому свободная поверхностная энергия может быть уменьшена не только за счет уменьшения поверхности S, но и за счет понижения поверхностного натяжения а; соответственно F может быть увеличена за счет увеличения о, что достигается в растворах изменением их состава.
Поэтому свободная поверхностная энергия может быть уменьшена не только за счет уменьшения величины поверхности S, но и за счет понижения величины поверхностного натяжения сг, что достигается в растворах изменением их состава. Этот путь имеет важное значение для многих проблем коллоидной химии.
Если свободная поверхностная энергия полимера известна, то можно рассчитать безопасное напряжение.
Понижение свободной поверхностной энергии, сопровождающее уменьшение величины поверхности, доходит до 900 кал / моль поверхностных атомов кремния, если считать, что на 1 нм2 приходится приблизительно 8 атомов кремния. Если коллоидные частицы стабилизированы термодинамически, то равновесная величина свободной энергии должна быть примерно такого же порядка. Эта стабилизирующая энергия появляется в результате адсорбции ионов ОН - и противоионов Na на поверхности коллоидных частиц.
Накопление свободной поверхностной энергии при образовании дисперсной системы повышает вероятность обратного процесса - объединения частиц в агрегаты, - уменьшающего дисперсность. Поэтому целью любого метода получения должно быть не только достижение требуемой дисперсности, но и закрепление этого состояния, стабилизация системы.
Накопление свободной поверхностной энергии при образовании дисперсной системы повышает вероятность обратного процесса - объединения частиц в агрегаты, - уменьшающего дисперсность.
Наличие свободной поверхностной энергии можно объяснить специфической неском-пенсированностью молекулярных сил (ненасыщенностью связей) на поверхности раздела фаз, вследствие чего образование новой поверхности требует затраты работы на выведение некоторого числа молекул из объема фаз на их поверхность, где взаимодействия между молекулами отличаются от взаимодействий в объеме фаз. Вблизи межфазной поверхности на расстояниях, соизмеримых с размером молекул, характерная для каждой фазы однородность состава и свойств не может сохраняться. Между фазами существует более или менее сильно развитый неоднородный слой, в котором осуществляется переход от свойств, характерных для одной фазы, к свойствам, характерным для другой.
Избытком свободной поверхностной энергии обладает и поверхность раздела твердое тело - жидкость.
Накопление свободной поверхностной энергии при образовании дисперсной системы повышает вероятность обратного процесса - объединения частиц в агрегаты, - уменьшающего дисперсность.
Изменение свободной поверхностной энергии, работы выхода обусловлены различными факторами и, прежде всего, связаны с адсорбцией компонентов среды на поверхности металла. Уменьшение свободной поверхностной энергии при адсорбции ПАВ приводит к пластифицированном металла (одно из проявлений эффекта Ребиндера) и в связи с локализацией трибонапряжений в тончайшем пластифцированном слое износостойкость пары трения обычно возрастает.
Величина свободной поверхностной энергии определяется соотношением сил, направленных внутрь жидкости и в газовую фазу.
Разность свободных поверхностных энергий на границе: твердое тело - газ, твердое тело - жидкость определяет молекулярную природу твердой поверхности.
Расчет свободной поверхностной энергии системы в этом случае осложнен тем, что из-за влияния силы тяжести капля несколько сплющена и ее форма отлична от шарового сегмента.
Величина свободной поверхностной энергии F (S) выражается соотношением: F (S) aS, где а - свободная энергия единицы поверхности (удельная свободная поверхностная энергия); S - площадь поверхности раздела фаз.
Мерой свободной поверхностной энергии единицы поверхности, как следует из уравнения (1), является поверхностное натяжение. Поэтому при обсуждении поверхностных явлений обычно говорят не о свободной поверхностной энергии, а о поверхностном натяжении, так как оно для поверхностей раздела жидкость - газ или жидкость - жидкость доступно измерению.
При адсорбции свободная поверхностная энергия уменьшается и A. Так как до адсорбции молекулы газа могут двигаться в трех направлениях, а после адсорбции либо прочно удерживаться на твердой поверхности, либо двигаться только в двух направлениях, процесс адсорбции сопровождается понижением энтропии и AS имеет отрицательное значение. Тогда из уравнения (а) следует, что АЯ также отрицательно. Это означает, что процессы адсорбции являются экзотермичными. Выделяющаяся при адсорбции теплота носит название теплоты адсорбции.
При адсорбции свободная поверхностная энергия уменьшается и А / - 1 отрицательна. Так как до адсорбции молекулы газа могут двигаться в трех направлениях, а после адсорбции на твердой поверхности - только в двух направлениях, процесс адсорбции сопровождается понижением энтропии и AS имеет отрицательное значение. Тогда из уравнения (а) следует, что Дп также отрицательно - Это означает, что процессы адсорбции являются экзотермичными. Выделяющаяся при адсорбции теплота носит название теплоты адсорбции.
В результате свободная поверхностная энергия сорбента уменьшается. Например, адсорбционная способность пористых стекол и силикагеля по отношению к парам воды зависит от количества концевых гидроксильных групп на поверхности сорбента.
Следствием существования свободной поверхностной энергии является факт появления разности давлений по обе стороны от поверхности жидкости при ее искривлении. Эта разность давлений носит название капиллярного давления. Градиент капиллярного давления всегда направлен к центру кривизны Поверхности. Поэтому для жидкости с вогнутой поверхностью капиллярное давление уменьшает внутреннее давление, а для жидкости с выпуклой поверхностью увеличивает.
Соответственно убыли свободной поверхностной энергии возрастают энергия, необходимая для последующего отрыва капли от твердой поверхности, и скорость ее приложения.
Снижением уровня свободной поверхностной энергии сопровождается укрупнение глобул воды, в эмульсиях и частиц в других системах, в связи с чем последние в принципе являются неустойчивыми и в идеале стремятся к расслоению на свободные фазы.
Зависимость изменения свободной поверхностной энергии от числа циклов имеет положительное числовое значение, так как увеличение поверхности с развитием дефектов и возникновением новых превышает размеры поверхности, исчезающей при установлении Новых когезионно-адгезион-ных связей в процессе высыхания. Все это не только возможно, но и совершенно необходимо для огромного большинства тел с более или менее жесткими структурами, способными оказывать механическое сопротивление деформирующему действию сил капиллярной контракции. В весьма жестких системах с неориентированными структурами вторичные связи устанавливаются с использованием очень малых поверхностей. В большинстве это точечные упорные контакты, где развиваются вторичные когезионные или адгезионные связи.
Определение величины свободной поверхностной энергии или поверхностного натяжения имеет значение при изучении адгезии.
Уменьшение запаса свободной поверхностной энергии в результате самопроизвольных процессов может произойти за счет уменьшения поверхностного натяжения или величины поверхности. Уменьшение поверхности, например, в глинистых породах проявляется в результате коагуляции и образования агрегатов. При агрегации увеличиваются общая пористость системы, размеры частиц и пор между ними, а также происходит возрастание потенциала влаги. Поверхностное натяжение может быть уменьшено за счет адсорбции.
Благодаря стремлению свободной поверхностной энергии к уменьшению в кристаллических полимерах возникают вторичные структуры - сферолиты и единичные кристаллы. Дефекты кристаллитов и свернутые молекулы составляют аморфную часть кристаллических полимеров.
б) Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости[1].
Сила поверхностного натяжения направлена по касательной к поверхности жидкости, перпендикулярно к участку контура, на который она действует и пропорциональна длине этого участка. Коэффициент пропорциональности  — сила, приходящаяся на единицу длины контура — называется коэффициентом поверхностного натяжения. Он измеряется в ньютонах на метр. Но более правильно дать определение поверхностному натяжению, как энергии (Дж) на разрыв единицы поверхности (м²). В этом случае появляется ясный физический смысл понятия поверхностного натяжения.
— сила, приходящаяся на единицу длины контура — называется коэффициентом поверхностного натяжения. Он измеряется в ньютонах на метр. Но более правильно дать определение поверхностному натяжению, как энергии (Дж) на разрыв единицы поверхности (м²). В этом случае появляется ясный физический смысл понятия поверхностного натяжения.
В 1983 году было доказано теоретически и подтверждено данными из справочников, что понятие поверхностного натяжения жидкости однозначно является частью понятия внутренней энергии (хотя и специфической: для симметричных молекул близких по форме к шарообразным). Приведенные в этой журнальной статье формулы позволяют для некоторых веществ теоретически рассчитывать значения поверхностного натяжения жидкости по другим физико-химическим свойствам, например, по теплоте парообразования или по внутренней энергии (подробнее о физической природе поверхностного натяжения жидкости см.соотв. статью на викиучебнике или [2])
В 1985 году аналогичный взгляд на физическую природу поверхностного натяжения, как части внутренней энергии, при решении другой физической задачи был.
Поверхностное натяжение может быть на границе газообразных, жидких и твёрдых тел. Обычно имеется в виду поверхностное натяжение жидких тел на границе «жидкость — газ». В случае жидкой поверхности раздела поверхностное натяжение правомерно также рассматривать как силу, действующую на единицу длины контура поверхности и стремящуюся сократить поверхность до минимума при заданных объёмах фаз.
В общем случае прибор для измерения поверхностного натяжения называется тензиометр.
Формулу для определения коэффициента поверхностного натяжения жидкости  можно записать через удельную теплоту парообразования r как:
можно записать через удельную теплоту парообразования r как:

или через внутреннюю энергию U:

где r – теплота парообразования, Дж/кг;
 – плотность жидкости, кг/ м3;
– плотность жидкости, кг/ м3;  – плотность пара, кг/ м3;
– плотность пара, кг/ м3;
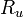 – универсальная газовая постоянная, Дж/(кмоль * K);
– универсальная газовая постоянная, Дж/(кмоль * K);
T – температура, K;
U – внутренняя энергия жидкости, Дж/кг;
M – молекулярная масса, кг/кмоль;
N – число Авогадро, кмоль-1;
 – масса одной молекулы жидкости, кг;
– масса одной молекулы жидкости, кг;
|
|
|


