 |
Окислительно-восстановительные свойства простых и сложных веществ
|
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой со знаком плюс при смещении электронов от данного атома к другому и цифрой со знаком минус при смещении электронов в обратном направлении. Цифру со знаком “+” или “-“ ставят над символом элемента. Степень окисления указывает состояние окисления атома и представляет собой всего лишь удобную форму для учета переноса электронов: ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно +0,89 и -0,89, тогда как степени окисления +1 и -1), ни как валентность элемента (например, в соединениях CH4, CH3OH, HCOOH, CO2 валентность углерода равна 4, а степени окисления соответственно равны 4, -2, +2, +4). Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной структурой.
При определении степени окисления используют следующие правила.
Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H2, N2 и т.п.
Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона,
+1 -1 +2 -2 +3 -1
например NaCl , Cu S, AlF3.
Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна -1.
|
|
|
Наиболее распространенная степень окисления кислорода в соединениях -2, за исключением пероксидов (Na2O2, Н2О2), в которых степень окисления кислорода равна –1, и F2O, в котором степень окисления кислорода равна +2.
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что алгебраическая сумма степеней окисления всех элементов в нейтральной молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO4, вычисленная исходя из суммарного заряда молекулы [1 + x + 4(-2)] = 0, где х – степень окисления атома хлора равна +7. Степень окисления атома серы в ионе (SO4)2- [х + 4(-2) = -2] равна +6.
Окислительно-восстановительные свойства простых и сложных веществ
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление - это процесс отдачи электронов атомом, ионом или молекулой реагента. Вещества, которые отдают свои электроны в процессе реакции и при этом окисляются, называют восстановителями.
Восстановление – это процесс принятия электронов атомом, ионом или молекулой реагента.
Вещества, которые принимают электроны и при этом восстанавливаются, называют окислителями.
Реакции окисления-восстановления всегда протекают как единый процесс, называемый окислительно-восстановительной реакцией. Например, при взаимодействии металлического цинка с ионами меди восстановитель (Zn) отдает свои электроны окислителю – ионам меди Cu2+:
Zn + Cu2+ 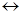 Zn2+ + Cu.
Zn2+ + Cu.
Медь выделяется на поверхности цинка, а ионы цинка переходят в раствор.
Окислительно-восстановительные свойства элементов связаны со строением их атомов и определяются положением в периодической системе Д.И. Менделеева. Восстановительная способность элемента обусловлена слабой связью валентных электронов с ядром. Атомы металлов, содержащие на внешнем энергетическом уровне небольшое число электронов, склонны к их отдаче, т.е. легко окисляются, играя роль восстановителей. Самые сильные восстановители – наиболее активные металлы.
|
|
|
Критерием окислительно-восстановительной активности элементов может служить величина их относительной электроотрицательности: чем она выше, тем сильнее выражена окислительная способность элемента, и чем ниже, тем ярче проявляется его восстановительная активность. Атомы неметаллов (например, F, O) обладают высоким значением сродства к электрону и относительной электроотрицательности, они легко принимают электроны, т.е. являются окислителями.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
В качестве примера рассмотрим серу S и ее соединения H2S, SO2 и SO3. Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в табл. 3.1.
В молекуле H2S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s23p6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
В низшей степени окисления атом теряет окислительную способность и может быть только восстановителем.
Таблица 3.1
| Формула вещества | Электронная формула | Окислительно-восстановительные свойства | |
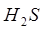
| 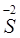 1s22s22p63s23p6
1s22s22p63s23p6
| 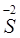 –2 –2 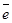   ; ; 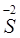 - 6 - 6 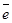   ; ; 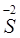 - 8 - 8 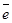   восстановитель восстановитель
| |

|  1s22s22p63s23p4
1s22s22p63s23p4
|
 + 2 + 2 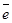  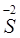 окислитель
окислитель
|  – 4 – 4 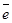   ; ;
 - 6 - 6 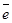   восстановитель
восстановитель
|
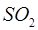
|  1s22s22p63s23po
1s22s22p63s23po
|  + 4 + 4 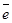   ; ;
 + 6 + 6 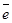  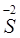 окислитель
окислитель
|
 -2 -2 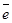   восстановитель восстановитель
|

|  1s22s22p63so3p0
1s22s22p63so3p0
|  + 2 + 2 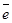   ; ;  + 6 + 6 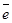   ; ;
 + 8 + 8 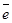  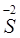 окислитель
окислитель
|
В молекуле SO3 все внешние электроны атома серы смещены к атомам кислорода. Следовательно, в этом случае атом серы может только принимать электроны, проявляя окислительные свойства.
Состояние атома, в котором он отдал все валентные электроны, называется высшей степенью окисления. Атом, находящийся в высшей степени окисления, может быть только окислителем.
|
|
|
В молекуле SO2 и элементарной сере S атом серы находится в промежуточных степенях окисления, т.е., имея валентные электроны, атом может их отдавать, но, не имея завершенного р - подуровня, может и принимать электроны до его завершения.
Атом элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства, что определяется его ролью в конкретной реакции.
Так, например, роль сульфит - аниона SO  в следующих реакциях различна:
в следующих реакциях различна:
5Na2SO3 +2KMnO4 +3H2SO4 ® 2MnSO4 + 5Na2SO4 + K2SO4+ 3H2O. (3.1)
H2SO3 + 2 H2S ® 3 S + 3 H2O. (3.2)
В реакции (1) сульфит-анион SO  в присутствии сильного окислителя KMnO4 играет роль восстановителя; в реакции (2) сульфит-анион SO
в присутствии сильного окислителя KMnO4 играет роль восстановителя; в реакции (2) сульфит-анион SO  - окислитель, так как H2S может проявлять только восстановительные свойства.
- окислитель, так как H2S может проявлять только восстановительные свойства.
Таким образом, среди сложных веществ восстановителями могут быть:
1) простые вещества, атомы которых обладают низкими значениями энергии ионизации и электроотрицательности (в частности, металлы);
2) сложные вещества, содержащие атомы в низших степенях окисления:
-1 -2 - 3
H Cl, H2 S, N H3;
3) сложные вещества, содержащие атомы в промежуточных степенях окисления:
+4 +2 +2
Na2 S O3, Fe Cl2, Sn (NO3)2.
Окислителями могут быть:
1) простые вещества, атомы которых обладают высокими значениями сродства к электрону и электроотрицательности, – неметаллы;
2) сложные вещества, содержащие атомы в высших степенях окисления: +7 +6 +7
K Mn O4, K2 Cr 2O7, HClO4;
3) сложные вещества, содержащие атомы в промежуточных степенях окисления:
+4 +4 +2
Na2 S O3, Mn O2, Mn SO4.
|
|
|


