 |
Задачи и упражнения для домашнего задания
|
|
|
|
1. Определить степени окисления атомов элементов, входящих в состав следующих соединений.
| № п/п | Вещества |
| 1.1 | K2S, Na2Cr2O7, H2CO3, Fe, SO2 |
| 1.2 | CaH2, MnO2, Al2SO4, F2, H3AsO4 |
| 1.3 | NH3, Ca, AlCl3, Fe2(SO4)3, Cr2O3 |
| 1.4 | I2, K2CrO4, CuS, NH4Cl, NaH |
| 1.5 | CuCl2, KMnO4, S, K2SO4, HBr |
| 1.6 | H3PO4 , NaNO3, K2SO3, K2Cr2O7, Mg |
| 1.7 | HNO3, PH3 , Na3PO4, H2O2, Ca |
| 1.8 | Na, HMnO4, H2SO4, FeCl3, NO2 |
| 1.9 | Na3AsO4, Zn, MnO2, H2O, H2S |
| 1.10 | PbO2, KClO3, LiNO3, Mn, H2SiO3 |
| 1.11 | Br2, CrCl3, NaNO2, HI, K2CrO4 |
| 1.12 | K2S, CuSO4, MnCl2, Cu, H2SO3 |
| 1.13 | NaNO3, Al, PbS, H3PO3 , O2 |
| 1.14 | HClO3 , K, Na2CrO4, CaSO4, Cl2 |
| 1.15 | Pb(NO3)2, K2MnO4, NO, HCl, H2 |
2. Какие окислительно-восстановительные процессы происходят при следующих превращениях и каким образом осуществляются в указанных рядах?
| № п/п | Ряды превращений |
| 2.1 | H2S  S S  SO2 SO2  SO3 SO3
|
| 2.2 | NH3  N2 N2  NO NO  N2O5 N2O5
|
| 2.3 | Cl2O7  HClO3 HClO3  HClO HClO  Cl2 Cl2  HCl HCl
|
| 2.4 | Mn  MnO MnO  MnO2 MnO2  HMnO4 HMnO4
|
| 2.5 | SO3  SO2 SO2  S S  H2S H2S
|
| 2.6 | AsH3  As As  As2O3 As2O3  As2O5 As2O5
|
| 2.7 | Cr3+  Cr6+; Feo Cr6+; Feo  Fe3+; Br5+ Fe3+; Br5+  Br- Br-
|
| 2.8 | N5+  N2+; Alo N2+; Alo  Al3+; Cl2 Al3+; Cl2  2Cl- 2Cl-
|
| 2.9 | S2-  So; Fe3+ So; Fe3+  Fe2+; P5+ Fe2+; P5+  P3- P3-
|
| 2.10 | N2+  N5+; N3- N5+; N3-  N5+; So N5+; So  S4+ S4+
|
| 2.11 | Cl-  Cl3+ Cl3+  Cl5+ Cl5+  Cl7+ Cl7+
|
| 2.12 | PH3  P P  P2O3 P2O3  P2O5 P2O5
|
| 2.13 | As3+  As5+; N3+ As5+; N3+  N3-; Pb N3-; Pb  Pb2+ Pb2+
|
| 2.14 | Mn6+  Mn2+; Cl5+ Mn2+; Cl5+  Cl-; I2 Cl-; I2  2I- 2I-
|
| 2.15 | Pb2+  PbO2; P3+ PbO2; P3+  P5+; Sn P5+; Sn  Sn2+ Sn2+
|
3. Для следующих окислительно-восстановительных реакций составить уравнения электронного баланса и подобрать коэффициенты.
| № п/п | Уравнения реакций |
| 3.1 | NaBr + NaBrO3 + H2SO4(среда)  Br2 + Na2SO4 + H2O Br2 + Na2SO4 + H2O
|
| 3.2 | K2Сr2O7+ Н2S + H2SO4(среда)  Сr2(SO4)3 + S + K2SO4 + Н2O Сr2(SO4)3 + S + K2SO4 + Н2O
|
| 3.3 | СrCl3 + Br2 + NaОН(среда)  Na2СrO4 + NaBr + NaCl + H2O Na2СrO4 + NaBr + NaCl + H2O
|
| 3.4 | КВr + КВrO3 + Н2SO4(среда)  Вr2 + К2SO4 + Н2О Вr2 + К2SO4 + Н2О
|
| 3.5 | NаJ + РbО2 + Н2SO4(среда)  РbSO4 + J2 + Na2SO4 + Н2О РbSO4 + J2 + Na2SO4 + Н2О
|
| 3.6 | КМnO4 + Nа2SO3 + КОН(среда)  K2MnO4 + Na2SO4 + H2O K2MnO4 + Na2SO4 + H2O
|
| 3.7 | FeSO4+К2Сr2O7 + Н2SO4  Fe2(SO4)3 +Сr2(SO4)3+K2SO4 + Н2O Fe2(SO4)3 +Сr2(SO4)3+K2SO4 + Н2O
|
| 3.8 | КМnO4 + КNO2 + Н2SO4(среда)  МnSO4 + КNО3 + К2SO4 + Н2O МnSO4 + КNО3 + К2SO4 + Н2O
|
| 3.9 | K2СrO4+ Н2S + H2SO4(среда)  Сr2(SO4)3 + S + K2SO4 + Н2O Сr2(SO4)3 + S + K2SO4 + Н2O
|
| 3.10 | FeSO4 + KJO3 + H2SO4(среда)  Fe2(SO4)3 + J2 + K2SO4 +H2O Fe2(SO4)3 + J2 + K2SO4 +H2O
|
| 3.11 | КМnO4 + Nа2SO3 + Н2O(среда)  MnO2 + Na2SO4 + KOH MnO2 + Na2SO4 + KOH
|
| 3.12 | NaNO2 + KJ + H2SO4(среда)  NaNO3 + J2 + K2SO4 + H2O NaNO3 + J2 + K2SO4 + H2O
|
| 3.13 | Al+ K2Cr2O7+ H2SO4(среда)  Al2(SO4)3 +Cr2(SO4)3 +K2SO4 +H2O Al2(SO4)3 +Cr2(SO4)3 +K2SO4 +H2O
|
| 3.14 | K2Сr2O7 + НJ + H2SO4(среда)  Сr2(SO4)3 + J2+ K2SO4 + Н2O Сr2(SO4)3 + J2+ K2SO4 + Н2O
|
| 3.15 | KJ + KJO3 + Н2SO4(среда)  J2 + K2SO4 + Н2О J2 + K2SO4 + Н2О
|
|
|
|
3.10. Варианты домашнего задания
| № варианта | № задачи | ||
| 1.1 | 2.1 | 3.1 | |
| 1.2 | 2.2 | 3.2 | |
| 1.3 | 2.3 | 3.3 | |
| 1.4 | 2.4 | 3.4 | |
| 1.5 | 2.5 | 3.5 | |
| 1.6 | 2.6 | 3.6 | |
| 1.7 | 2.7 | 3.7 | |
| 1.8 | 2.8 | 3.8 | |
| 1.9 | 2.9 | 3.9 | |
| 1.10 | 2.10 | 3.10 | |
| 1.11 | 2.11 | 3.11 | |
| 1.12 | 2.12 | 3.12 | |
| 1.13 | 2.13 | 3.13 | |
| 1.14 | 2.14 | 3.14 | |
| 1.15 | 2.15 | 3.15 |
Экспериментальная часть
Лабораторная работа
“Изучение окислительно - восстановительных реакций”
Опыт 1. Окислительное действие сложного иона
1. Экспериментально определить продукты реакции.
В пробирку налить 2 мл раствора бихромата калия, добавить 1,5 мл разбавленной серной кислоты H2SO4 для придания кислотного характера среды и небольшими порциями прибавлять раствор сульфата железа (II) FeSO4 до появления зеленой окраски. Зеленая окраска раствора обусловлена наличием ионов хрома Cr3+.
Написать уравнение реакции:
K2Cr2O7 + FeSO4 + H2SO4 (среда) 
Продуктами реакции являются сульфаты Fe3+, Cr3+, К+ и вода.
2. Определить степени окисления элементов, входящих в состав исходных веществ и продуктов реакции. Указать, какую роль в связи с этим они могут играть в реакции окисления – восстановления?
3. Выбрать восстановитель и окислитель.
4. Составить уравнение электронного баланса, подобрать нужные коэффициенты в уравнении реакции.
Опыт 2. Влияние различных степеней окисления иода на его роль в окислительно - восстановительных реакциях
Цель опыта - оценить возможность взаимодействия KI c KJO3 в кислой среде.
1. Экспериментально определить продукты реакции.
В пробирку налить 2 мл раствора KJO3, добавить 1мл разбавленной серной кислоты и небольшими порциями добавить 2 мл раствора KI. Что наблюдается? Внести 2…3 капли раствора крахмала. На образование какого вещества указывает появление синего окрашивания раствора?
Написать уравнение реакции:
|
|
|
KI + KJO3 + H2SO4 (среда) 
Продуктами реакции являются йод, сульфат калия и вода.
2. Установить степень окисления иода в молекулах и на основании этого определить роль каждой молекулы в реакции окисления – восстановления.
3. Составить уравнение электронного баланса, подобрать нужные коэффициенты в уравнении реакции.
4. К какому типу окислительно-восстановительных реакций относится данная реакция?
Опыт 3. Окислительно - восстановительные свойства атомов, находящихся в промежуточной степени окисления
1. Экспериментально определить продукты реакции.
В две пробирки налить по 2 мл раствора нитрита калия KNO2, добавить 1мл разбавленной серной кислоты для создания характера среды. В одну пробирку добавить небольшими порциями раствор перманганата калия KMnO4, а в другую – сульфида калия K2S до появления видимых признаков изменения растворов.
Написать уравнения происходящих реакций.
KNO2+ KMnO4 + H2SO4 (среда)  (1)
(1)
В первой реакции KNO2 превращается в KNO3, кроме того, образуются сульфаты Mn2+, K+ и вода.
KNO2 + K2S + H2SO4 (среда)  (2)
(2)
Во второй реакции выпадает в осадок сера S, выделяется окись азота NO, образуется сульфат калия и вода.
2. Определить степени окисления элементов, входящих в состав исходных веществ и продуктов реакции. Почему KNO2 может проявлять свойства и окислителя, и восстановителя?
3. Указать роль KNO2 в каждой реакции.
4. Составить уравнения электронного баланса, подобрать нужные коэффициенты в уравнениях реакций.
Опыт 4. Влияние среды на характер окислительно-восстановительных реакций
1. Экспериментально определить продукты реакции.
В три пробирки налить по 2…3 мл раствора перманганата калия KMnO4. Для создания нужного характера среды в первую пробирку добавить 1…2 мл разбавленной серной кислоты, во вторую – такой же объем воды, в третью – концентрированный раствор едкого калия (30% - ный раствор КОН).
В каждую пробирку приливать небольшими порциями (при взбалтывании) раствор сульфита натрия Na2SO3. Наблюдать и отмечать происходящие изменения. Обратить внимание на то, что реакция в щелочной среде происходит в две стадии.
Написать уравнения происходящих реакций:
KMnO4 + Na2SO3 + H2SO4 (среда)  (1)
(1)
|
|
|
KMnO4 + Na2SO3 + H2О (среда)  (2)
(2)
KMnO4 + Na2SO3 + КОН(среда)  K2MnO4 + … (3,а)
K2MnO4 + … (3,а)
3 K2MnO4+ 2 H2O 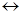 2 KMnO4+ MnO2 + 4 KOH (3,б)
2 KMnO4+ MnO2 + 4 KOH (3,б)
Примечание: При составлении правой части каждого уравнения следует обратить внимание на:
а) во всех средах Na2SO3 превращается в Na2SO4;
б) в кислой среде образуются также сульфаты марганца, калия и вода;
в) в нейтральной среде образуется диоксид марганца MnO2 и гидроксид калия КОН;
г) в щелочной среде на первой стадии образуется K2MnO4 и вода.
2. По положению марганца в периодической системе элементов определить его возможные степени окисления. Указать степень окисления атома марганца в молекуле KMnO4 и на основании этого определить роль KMnO4 в окислительно–восстановительных реакциях.
3.Определить степень окисления атома серы в Na2SO3. Указать, какую роль в связи с этим Na2SO3 может играть в реакции окисления – восстановления в паре с КMnO4?
4. На основании проделанных опытов сделать вывод, в какой среде процесс восстановления протекает наиболее интенсивно.
5. Составить уравнения электронного баланса, подобрать нужные коэффициенты в уравнениях реакций.
|
|
|


