 |
Влияние среды на характер окислительно - восстановительных реакций
|
|
|
|
В зависимости от рН среды меняется характер протекания окислительно-восстановительного процесса между одними и теми же реагентами. Например, взаимодействие восстановителя сульфита натрия Na2SO3 с окислителем перманганатом калия KMnO4 в кислотной (рН < 7), нейтральной (pH = 7) и щелочной (pH >7) среде приводит к образованию различных продуктов:

Na2SO3 + K MnO 4  N a2SO4 + Mn SO4 + K2SO4 (pH <7),
N a2SO4 + Mn SO4 + K2SO4 (pH <7),
Na2SO3 + K MnO 4 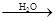 Na2SO4 + MnO 2 + KOH (pH =7),
Na2SO4 + MnO 2 + KOH (pH =7),
Na2SO3 + K MnO 4 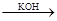 Na2SO4 + K2 MnO 4 + H2O (pH >7).
Na2SO4 + K2 MnO 4 + H2O (pH >7).
Получение различных продуктов объясняется различным поляризующим действием протона (Н+), полярных молекул воды и гидроксид-аниона (ОН-). Максимальное поляризующее действие оказывает протон: внедряясь в анион MnO4-, ослабляет связь между марганцем и кислородом, усиливая действие восстановителя, при этом степень окисления марганца изменяется в большей степени от +7 до +2.
Поляризующее влияние диполей воды слабее, чем у протона, а гидроксид-анионы, имея большой радиус иона и малый заряд, практически не оказывают поляризующего действия.
Характер среды оказывает влияние и на направление окислительно-восстановительной реакции. Так, реакция
3 J2 + 3 H2O 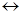 6 H+ + JO-3 + 5 J-.
6 H+ + JO-3 + 5 J-.
в зависимости от характера среды может протекать как в прямом, так и в обратном направлении. Прибавление к раствору кислоты (понижение рН) вызывает увеличение концентрации ионов Н+ и в соответствии с принципом Ле Шателье смещает равновесие в сторону обратной реакции. Прибавление раствора щелочи (повышение рН) смещает равновесие в направлении прямой реакции.
Направление окислительно-восстановительных реакций
Самопроизвольное протекание окислительно-восстановительной реакции определяется неравенством 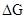 < 0 (
< 0 (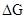 - энергия Гиббса). Если указанная энергия выше нуля (
- энергия Гиббса). Если указанная энергия выше нуля (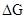 > 0), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. Энергию Гиббса реакции можно рассчитать, зная стандартные значения
> 0), то прямая реакция в данных условиях невозможна, а возможна лишь обратная реакция. Энергию Гиббса реакции можно рассчитать, зная стандартные значения  реакций образования продуктов и исходных веществ [3].
реакций образования продуктов и исходных веществ [3].
|
|
|
Рассмотрим для примера направление реакции взаимодействия магния с водой:
Mg(тв) + H2O(ж) 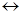 MgO(тв) + H2(г).
MgO(тв) + H2(г).
Выпишем значения  для всех веществ, участвующих в реакции, и рассчитаем изменение энергии Гиббса реакции, используя уравнение
для всех веществ, участвующих в реакции, и рассчитаем изменение энергии Гиббса реакции, используя уравнение
 .
.
| Вещества | Mg(тв) | H2O(ж) | MgO(тв) | H2(г) |
 ,кДж/моль ,кДж/моль
| 0,0 | -237,2 | -569,4 | 0,0 |
Энергия Гиббса реакции при стандартных состояниях равна 296,2 кДж/моль, т.е. в данных условиях возможно окисление магния водой:
Mg + H2O(ж)  MgO + H2(г),
MgO + H2(г),
а обратная реакция окисления водорода оксидом магния невозможна.
Вопросы для самоконтроля
1. Определение понятий: окисление, восстановление, окислитель, восстановитель.
2. Степени окисления элементов в простых и сложных веществах. Высшая, низшая и промежуточные степени окисления элементов. Как отражается изменение степени окисления элемента на его окислительно-восстановительных свойствах? Привести примеры.
3. Критерий самопроизвольного протекания окислительно-восстановительной реакции.
4. Составьте уравнение окислительно-восстановительной реакции, используя метод электронного баланса:
KBr + KBrO3 + H2SO4  Br2 + K2SO4 + H2O.
Br2 + K2SO4 + H2O.
Литература
1. Глинка Н.Л. Общая химия. - М: Интеграл-Пресс, 2002. Гл.9. § 9.1-9.3.
2. Коровин Н.В. Общая химия. - М: Высшая школа, 2002. Гл.9. § 9.1.
3. Болячевская К.И., Полякова Е.В. Справочные материалы по общему и элективным курсам /Под ред. проф. И.М.Паписова/; МАДИ (ГТУ). – М., 2004.
Примеры решения задач
Пример 1. Определить степени окисления атомов в следующих соединениях: K2Cr2O7, (SO3)2-, CO.
Решение.
+1 x -2 x -2 x -2
K2Cr2O7 (SO3)2- CO
2(+1) + 2x +7(-2) = 0 x + 3(-2) = -2 x + (-2) = 0
x = + 6x = + 4x = + 2
Пример 2. Какие окислительно-восстановительные процессы происходят при следующих превращениях:
|
|
|
Pb  Pb2+; MnO4-
Pb2+; MnO4-  MnO42-; Cl2
MnO42-; Cl2  2Cl- ?
2Cl- ?
Решение.
1. Определим степени окисления всех элементов:
0 +2 +7 -2 +2 -2 0 -1
Pb  Pb2+; MnO4-
Pb2+; MnO4-  MnO42-; Cl2
MnO42-; Cl2  2Cl-.
2Cl-.
2. Повышение степени окисления происходит в процессе окисления, а понижение – при восстановлении. Следовательно,
Pb  Pb2+ + 2
Pb2+ + 2 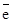 (процесс окисления),
(процесс окисления),
MnO4- + 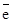
 MnO42 (процесс восстановления),
MnO42 (процесс восстановления),
Cl2 + 2 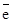
 2Cl- (процесс восстановления).
2Cl- (процесс восстановления).
Пример 3. Составить уравнение окислительно-восстановительной реакции, протекающей по схеме:
KMnO4 + H3PO3 + H2SO4(среда)  MnSO4 + H3PO4 + K2SO4 + H2O.
MnSO4 + H3PO4 + K2SO4 + H2O.
Решение. Определяем степени окисления элементов в исходных веществах и продуктах реакции:
+1+ 7 -2 +1 +3 -2 +1 +6 -2 +2 +6 -2 +1 +5 -2 +1 +6 -2 +1 -2
KMnO4 + H3PO3 + H2SO4  MnSO4 + H3P O4 + K2SO4 + H2O.
MnSO4 + H3P O4 + K2SO4 + H2O.
Осуществляем выбор окислителя и восстановителя.
KMnO4 – окислитель, так как степень окисления марганца в реакции понижается. H3PO3 - восстановитель, так как степень окисления фосфора в ходе реакции повышается.
Составляем уравнения электронного баланса для окислителя и восстановителя:
+3 +5
 восстановитель 5 Р
восстановитель 5 Р  Р + 2
Р + 2 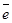 (процесс окисления)
(процесс окисления)
+7 +2
окислитель 2 Мn + 5 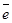
 Мn (процесс восстановления)
Мn (процесс восстановления)

+3 +7 +5 +2
5 Р+3 + 2 Мn+7  5 Р+ 2 Мn
5 Р+ 2 Мn
Стехиометрические коэффициенты определяем методом электронного баланса с помощью электронных уравнений. Общее число электронов, отданных восстановителем, равно числу электронов, присоединяемых окислителем. Наименьшее общее кратное для отданных (2) и принятых электронов (5) равно 10. Для восстановителя и продукта его окисления получаем коэффициент 5, для окислителя и продукта его восстановления – коэффициент 2.
Уравнение реакции имеет вид:
2 КМnO4 + 5 Н3РО3, + З Н2SO4  2 МnSO4 + 5 Н3РО4 + К2SO4 + З Н2O.
2 МnSO4 + 5 Н3РО4 + К2SO4 + З Н2O.
Коэффициенты перед веществами, атомы которых не изменяют свою степень окисления, находим методом подбора.
Число атомов кислорода в левой и правой частях уравнения одинаковое (8+15+12 = 8+20+4+3), значит, данное уравнение является окончательным.
|
|
|


