 |
Составление уравнений окислительно-восстановительных реакций
|
|
|
|
Составление уравнений окислительно-восстановительных реакций – задача более сложная, чем в случае реакций обмена. Это связано с тем, что в ходе окислительно-восстановительного процесса изменяются степени окисления атомов, входящих в состав реагирующих веществ.
Для записи уравнения любой реакции прежде всего необходимо знать формулы исходных веществ и продуктов.
Вопрос о продуктах реакции может быть решен или экспериментально, анализируя состав реакционной системы, или теоретически, используя значения стандартных окислительно-восстановительных потенциалов (Е0).
Предложено несколько методов составления окислительно-восстановительных реакций.
Метод электронно-ионного баланса основан на использовании значений стандартных окислительно-восстановительных потенциалов при выборе окислителя и восстановителя, составлении электронно-ионных уравнений с последующим суммированием двух уравнений, записанных для процессов окисления и восстановления, в ионно-молекулярное уравнение. Метод электронно-ионного баланса используется в основном для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водных растворах. Этот метод имеет то преимущество, что при его применении необязательно знать степени окисления атомов, участвующих в реакции ионов.
В данной работе при составлении окислительно-восстановительных реакций используется метод электронного баланса и продукты окислительно-восстановительных реакций определены.
Метод электронного баланса применим для составления уравнений окислительно-восстановительных процессов, протекающих как в растворах и расплавах, так и в твердых и газообразных системах. Данный метод основан на сравнении степеней окисления атомов в исходных и конечных веществах и последующем составлении схемы электронного баланса.
|
|
|
Задача состоит в подборе и расстановке коэффициентов.
Коэффициенты подбирают методом электронного баланса с помощью электронных уравнений, учитывая правила сохранения числа атомов каждого элемента в реакции и сохранения заряда.
Число одноименных атомов в левой и правой частях уравнения должно быть одинаковое.
Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Рассмотрим пример составления окислительно-восстановительной реакции между перманганатом калия KMnO4 и сульфидом калия K2S в кислой среде:
K2S + KMnO4 + H2SO4 ® K2SO4 + MnSO4 + S + H2O.
1. Определяем степени окисления элементов в исходных веществах и продуктах реакции:
+1 -2 +1 +7 -2 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
K2 S + K Mn O4 + H2SO4(среда) ® Mn SO4 + S + K2SO4+ H2O.
В данной реакции изменяются степени окисления атомов серы от –2 до 0 и марганца от +7 до +2.
2. Выбираем восстановитель и окислитель.
Так как в данной реакции степень окисления серы повышается, а марганца понижается, то K2S - восстановитель, а KMnO4 – окислитель.
3. Определяем число электронов, отдаваемых восстановителем и принимаемых окислителем, и записываем схему перехода электронов, состоящую из уравнений процессов окисления и восстановления:
5  S-2
S-2 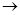 S0 + 2
S0 + 2 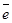 (процесс окисления)
(процесс окисления)
2 Mn+7 + 5 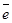
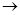 Mn+2 (процесс восстановления)
Mn+2 (процесс восстановления)

5 S-2 + 2 Mn+7 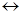 5 Sо+ 2 Mn+2
5 Sо+ 2 Mn+2
Стехиометрические коэффициенты определяем методом электронного баланса с помощью электронных уравнений. Общее число электронов, отданных восстановителем, равно числу электронов, присоединяемых окислителем. Наименьшее общее кратное для отданных (2) и принятых электронов (5) равно 10. Для восстановителя и продукта его окисления получаем коэффициент 5, для окислителя и продукта его восстановления – коэффициент 2. Коэффициенты перед веществами, атомы которых не изменяют свою степень окисления, находим методом подбора.
|
|
|
4. Записываем уравнение реакции с учетом найденных коэффициентов:
2 KMnO4 + 5 K2S + 8 H2SO4 ® 2 MnSO4 + 5 S + 6 K2SO4 + 8 H2O.
Правильность подобранных коэффициентов определяем балансом кислорода в обеих частях уравнения (8 + 32 = 8 + 24 + 8). Число атомов кислорода в левой и правой частях уравнения одинаковое, поэтому данное уравнение является окончательным.
|
|
|


