 |
Нейрофармакологическая коррекция гемодинамических болевых реакций
|
|
|
|
Экспериментальные и клинические данные свидетельствуют о том, что морфиноподобные анальгетики в оптимальных болеутоляющих дозах могут разнонаправление, но умеренно изменять системное артериальное давление и частоту сердечных сокращений, уменьшать тонус вен и сердечный индекс, что нередко сочетается с повышением общего периферического сопротивления [подробнее см.: Inturrisi С., 1984; Pfeiffer N., Illes P., 1984; Korinek A., 1985]. Более значимы гемодинамические эффекты опиатов при патологии сердечно-сосудистой системы, в частности при инфаркте миокарда и диагностических (коронарография) и лечебных (аортокоронарное шунтирование) манипуляциях при ишемичсской болезни сердца. После их применения отмечают электрическую нестабильность миокарда, кардиодепрессивный эффект, даже некоторое увеличение размеров инфаркта. Наркотические анальгетики последних лет, в частности новые аналоги фентанила — суфептанил, альфентанил, карфентанил и др., обеспечивают более стабильное состояние центрального и периферического кровообращения, таким же свойством обладает и бупренорфин (темгесик), вызывающий быстро наступающую и длительную аналгезию [подробнее см.: Осипова Н.А., 1988; Hug С., 1984; Davis P., Cook D, 1986; Freye R., 1987]. Данные о других опиоидах (петидин, буторфанол, налбуфин, трамадол и др.) фрагментарны и не позволяют сделать заключения об их гемодинамическом действии.
Помимо изыскания и изучения новых препаратов, предпринимаются попытки совершенствования опиатной аналгезии с помощью их более рационального использования. В качестве такого способа рассматривается метод непосредственной доставки анальгетиков к структурам спинного мозга: эпидуральное и субарахноидальное (интратекальное) введение, — снижающий их расход и пролонгирующий действие. Тем не менее и при таком способе введения наблюдаются разнонаправленные сдвиги фоновых показателей кровообращения, нередко развивающиеся на фоне угнетения дыхания [Devaux С., Tessier С., 1984].
|
|
|
Еще более важным является вопрос о способности анальгетиков устранять или ослаблять вегетативные реакции, обусловленные нопицептивной афферентацией. В экспериментах показано, что морфин уже в дозах 0,2—1 мг/кг налоксонзависимо ослабляет реакции артериального давления, вызванные растяжением почечных лоханок у крыс. Однако у наркотизированных кошек морфин в дозе 1 мг/кг не влияет на А- и С-соматосимпатические рефлекторные ответы в нижнем сердечном нерве, а в дозе 2 мг/кг тормозит только их С-компонент [Sato Y., Swenson R., 1984]. На фоне морфина в дозе 2 мг/кг не изменяются гемодинамические компоненты электроболевого шока у кроликов, резко возрастает уровень катехоламинов в плазме [Brown M. et al., 1983].
У кардиохирургичсских больных морфин в больших дозах, обеспечивающих его концентрацию в плазме не менее 0,45—0,6 мкг/мл, предупреждает такие признаки неадекватного обезболивания, как подъем артериального давления, тахикардия, десинхронизация ЭЭГ [Лепахин В.К. и др., 1982]. По данным Э.Л. Петровской и соавт. (1980), при использовании морфина в качестве единственного либо основного компонента общей анестезии (5—6 мг/кг) сохраняется высокая частота развития гипертензивных и тахикардических сдвигов, обусловленных хирургической травмой, а в больших дозах морфин ощутимо угнетает дыхание. Морфин не препятствует подъему артериального давления в процессе интубации, при ортопедических и общехирургических манипуляциях. На его фоне наблюдается повышение артериального давления и частоты сердечных сокращений на 15—20 % от их исходных значений, возрастает давление в легочных капиллярах, патологически изменяются ЭКГ и дыхание [Diehl D. et al., 1983; Ghoneim M. et al, 1984: Flacke J. et al., 1985].
|
|
|
Данные по фентанилу еще более определенно свидетельствуют о недостаточной защите сердечно-сосудистой системы от болевой агрессии [Biber В., Mariner J., 1981; Niv D., Whitmam J., 1983; Arnodt J. et al., 1984; Askitopoulou Н. et al., 1985]. У кошек на фоне фентанила в сочетании с закисью азота сохраняется сужение сосудов почек и чревной области, обусловленное стимуляцией С-волокон соматических афферентных нервов, а у собак фентанил в дозах меньше 100 мкг/кг даже усиливает прессорные и тахикардические реакции, вызванные сверхмаксимальным раздражением лучевого нерва. Показано, что у крыс отношение RAso фентанила, вызывающей торможение моторных и тахикардических ноцицептивных реакций, составляет 1:33 [Kissin I. et al., 1983]. Иными словами, вегетокорригирующее действие фентанил оказывает только в очень больших (токсических) дозах. Так, у бодрствующих собак торможение гемодинамических реакций в ответ на болевое сжатие хвоста развивается под влиянием фентанила в дозе 40 мкг/(мин•кг), которая отчетливо угнетает дыхание, вызывает гипотензию и брадикардию. У наркотизированных собак угнетение С-компонента соматосимпатичсского рефлекса в почечном нерве фентанил вызывает лишь в дозе 90 мкг/кг. Экспериментальные данные подтверждаются клиническими наблюдениями, в которых зарегистрировано достоверное изменение артериального давления и других показателей центральной гемодинамики на фоне фентанила в дозах до 50—70 мкг/кг в период интубации или травматических этапов операции [Stanley Т., 1983; Murkfn J. et al., 1984]. Аналогичные результаты получены в отношении более эффективного, чем фентанил, анальгетика суфентанила [Moore R. et al, 1985].
Общеизвестно, что гемодинамические проявления боли в рамках их общей гипердинамической направленности весьма варьируют. С этих позиций, вероятны и индивидуальные различия гемодинамических эффектов анальгетиков, которые могут быть обусловлены особенностями исходного состояния организма. Использованный нами метод многофакторного анализа на ЭВМ СМ-3 с помощью уравнений пошаговой регрессии [Зайцев А.А., Бершадский Б.Г., 1983] позволил установить зависимость изменений ноцицептивных гемодинамических реакций не только от дозы анальгетиков, но и от исходного состояния конкретного животного. В качестве факторов, отражающих исходное состояние, учитывались эмоциональная реактивность, уровни артериального давления и частоты сердечных сокращений (мгновенные значения межсистольных интервалов), показатели процессов регуляции кровообращения — собственные (чувствительность барорефлекса, вызванного мезатоном) и сопряженные (сдвиги артериального давления и частоты сердцебиений при раздражении пульпы зуба) вазомоторные рефлексы. Оригинальная программа для ЭВМ на первом и каждом последующем шаге вводила в уравнение регрессии фактор, в наибольшей степени (при р не ниже 0,01) коррелирующий с эффектом вещества, из числа факторов, не учтенных программой ранее. Многофакторный анализ показал, например, что для всех подопытных животных характерна резистентность тахикардических ноцицептивных реакций к действию фентанила (рис. 21). Однако у исходно высокоэмоциональных кошек препарат в анальгетической дозе 15 мкг/кг вызывает значительное увеличение тахикардии в ответ на ноцицептивное раздражение. В свою очередь, при минимальных значениях барорефлексов и ноцицептивных реакций артериального давления в контроле фентанил практически не уменьшал гипертензивные реакции. Его угнетающее влияние на сдвиги артериального давления наиболее отчетливо было выражено при исходной высокой чувствительности барорецепторных рефлексов. Аналогичным образом была установлена прямая зависимость эффекта морфина, промсдола и других препаратов от исходных значений гемодинамических реакций, вызванных ноцицептивным раздражением. Примечательно, что если особенности влияния анальгетиков на тахикардические реакции зависели прежде всего от эмоциональной реактивности животных, то изменения реакций артериального давления определялись другими показателями исходного состояния организма.
|
|
|
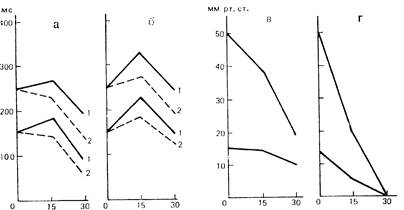
Рис. 21. Результаты многофакторного анализа влияния фентанила на изменения межсистольных интервалов (а, б) и реакции артериального давления (в, г) при раздражении пульпы зуба у кошек.
|
|
|
По оси абсцисс — доза фентанила (мкг/кг); по осям ординат — а, б — реакции межсистольных интерпалов; в, г — реакции артериального давления. 1 — изменения показателен через 10 мин; 2 — через 25 мин после введения фетаннла. а, б — из менения реакции межсистольных интервалов соответственно при минимальной и максимальной эмоциональной реактивности животных, в, г — изменения реакции артериального давления соответственно при минимальных и максимальных значениях барорефлекса.
Приведенные данные показали, что вариабельность гемодинамических эффектов анальгетиков в рамках общей направленности их эффекта во многом обусловлена зависимостью действия препаратов от конкретных показателей исходного состояния организма. Следовательно, выявление подобных зависимостей может быть использовано для прогнозирования влияния опиатов и опиоидов на проявления болевого синдрома у конкретного организма на основе набора исходных показателей и тем самым явиться основой для индивидуализированной болеутоляющей терапии.
Прикладная ценность такого подхода была испытана при анализе анестезиологического пособия с помощью промедола в родах в рандомизированном исследовании в НИИ акушерства и гинекологии (Ленинград). В этой работе с помощью многофакторного анализа, оценивали изменении базальноги тонуса матки (как косвенное отражение болеутоляющей эффективности промедола) в зависимости от вызываемых промедолом сдвигов системной гемодинамики у рожениц, (артериального давления сердечного индекса, общего периферического сопротивлении и др., определяемых методом интегральной реографии), родовой деятельности (частоты схваток, амплитуды внутриматочного давления) и доз анальгетика — в среднем 0.4 и 0,6 мг/кг внутривенно. Кроме того, специально анализировали состояние плода по частоте сердцебиений, их колебаниям, миокардиальному рефлексу — на фоне промедоловой аналгезии в зависимости от дозы препарата, изменений системной гемодинамики женщины и базального тонуса матки (табл. 9) [Абрамченко В.В., Моисеев В.Н., 1986].
Т а б л и ц а 9
Влияние промедола на показатели центральной гелюдинамика, сократительной деятельности матки и внутриутробного состояния плода в родах
| Показатель (n=20) | Контроль | После введения промедола (0,3-0,6 мг/кг) | |
| Через 5 мин | через 25 мин | ||
| Центральная гемодннамика рожениц: | |||
| ударный индекс, мл/м2 | 33±0,6 | 22±1,0* | 41±0,7 |
| сердечный индекс, л/м2/мин | 2,96±0,06 | 2,32±0,07* | 3,34±0,06* |
| частота сердечные сокращений, уд/мин | 90± 1 | 111±3* | 82±1* |
| среднединамическое артериальное давление, мм рт. ст. | 85± 1 | 97±2 | 82±1 |
| общее периферическое сопротивление, мм рт. ст./(мл •мин) | 29,02±0,31 | 42,80±0,42* | 24,67±0,29* |
| коэффициент интегральной тоничности, усл. ед. | 79,4±0,2 | 83,6±0,6* | 77,6±0,2 |
| коэффициент дыхательных измене-ний ударного объема сердиа, усл. ел. | 1,94±0,10 | 2,47±0,16* | 1,70±0,06* |
| Сократительная деятельность матки: | |||
| частота схваток (за 10 мин) | 2,9±0,1 | 2,0±0,1* | 2,6±0,1* |
| амплитуда схваток, мм рт. ст. | 54±3 | 40±2 * | 48±2 |
| базальный тонус матки, мм рт. ст. | 8,3±0.4 | 5,4±0,4* | 5,1±0,3* |
| Внутриутробнос cocтояние плеяда. | |||
| частота сердечных сокращений, уд/мин | 143±2 | 119±2* | 144±3 |
| внутриминутные колебания частоты сердечных сокращений | 12,7±0.7 | 3,6±0,6* | 14,1.±0,8 |
| миокардиальный рефлекс | 18,3±0,6 | 9,5±0,7 | 19,8±0,8 |
* р < 0,005 при сравнении с контролем.
|
|
|
Многофакторный анализ выявил неизвестные ранее важные клинические закономерности, в частности взаимосвязь изменений под влиянием промедола, независимо от его дозы, схваток и базального тонуса матки, и показал, что промедол не рационально использовать при недостаточной родовой деятельности, поскольку развитие анальгетического эффекта препарата неизбежно сочетается с ослаблением схваток. Более того, на фоне промедоловой аналгезии возможно снижение функционального состояния плода. Этот эффект также не имеет дозозависимого характера и во многом определяется вызываемым промедолом у ряда рожениц уменьшением сердечного индекса, с которым высокодостоверно коррелируют брадикардия, торможение колебаний частоты сердечных сокращений и миокардиального рефлекса у плода. В свою очередь, угнетение промедолом сердечного индекса наиболее вероятно при его исходно высоких значениях, что определяет контингент женщин, у которых нежелательно применение промедола для обезболивания родов.
Таким образом, существует возможность оптимизации опиатной аналгезии посредством ее индивидуализации, что, тем не менее, нельзя признать радикальным решением проблемы фармакологической регуляции гемодинамических проявлений боли. Во-первых, даже у лиц, для которых применение опиатов является наиболее оправданным, препараты не обеспечивают стабилизации сердечно-сосудистой системы при болевых синдромах. Во-вторых, индивидуализация терапии в итоге сводится к отмене анальгетика у определенного контингента больных или уменьшению дозы препарата, что ставит задачу адекватной замены опиатов.
На наш взгляд, в основе резистентности гемодинамических проявлений боли к существующим анальгетикам лежит разобщенность опиоидергической регуляции боли и гемодинамических ноцицептивных реакций [Игнатов Ю.Д., Зайцев А.А., 1984]. Правомочность такого предположения подтверждается вариантом математического моделирования, при котором в уравнения регрессии, кроме упоминавшихся показателей исходного состояния, вводили в качестве дополнительных факторов изменения эмоционально-болевой реактивности, вызываемые болеутоляющими средствами. Компьютерный анализ показал, что при неизменности эмоционально-аффективного реагирования гемодинамические эффекты анальгетиков полностью сохранялись.
Разобщенность опиоидергической регуляции разномодальных ноцицептивных реакций обусловлена комплексом взаимосвязанных причин, в основе которых лежат рецепторные механизмы. Естественно, что морфиноподобные препараты, одновременно воздействующие на μ-, δ- и х-опиатные рецепторы, не могут надежно устранить сдвиги сердечно-сосудистой системы, поскольку каждый из этих рецепторов опосредует разнонаправленные реакции артериального давления при ноцицепции. Учитывая это, а также социальную опасность наркотических анальгетиков, одним из оптимальных направлений совершенствования лекарственной аналгезии следует считать разработку способов неопиатной аналгезии с помощью «неспецифических» болеутоляющих средств. Среди последних наиболее широко используются транквилизаторы бензодиазепинового ряда [подробнее см.: Вальдман А.В. и др., 1979]. В литературе широко описано влияние различных бензодиазепинов на фоновые уровни гемодинамических показателей, однако практически отсутствуют данные об их эффекте в условиях ноцицептивного воздействия. Известно, что у экспериментальных животных и людей эталонный препарат диазепам (сибазон) в общепринятых дозах практически не изменяет артериальное давление, частоту сердечных сокращений, тонус сосудов в разных регионах и не угнетает дыхание. В условиях эмоционального стресса диазепам и хлордиазепоксид (хлозепид) уменьшают прессорные сдвиги артериального давления и тахикардию у ненаркотизированных кошек и крыс, устраняют гипсрдинамические реакции при активации эмоциогенных зон головного мозга. Однако бензодиазепиновые транквилизаторы не оказывают вегетокорригирующего действия при боли. Так, диазепам в дозах до 10 мг/кг не угнетает тахикардию и повышение уровня кортикостероидов в плазме крови ненаркотизнрованных крыс в ответ на электроболевое раздражение, не препятствует повышению сердечного выброса при лечении зубов [Dionne R. et al., 1984]. Диазепам и хлордиазепоксид могут даже усиливать гипертензивные и тахикардические реакции у бодрствующих кошек при ноцицептивном раздражении большеберцового нерва [Розонов Ю.Б., 1976]. По нашим данным, диазепам, нитразепам и медазепам уменьшали время восстановления показателей системной гемодинамики и дыхания после прекращения ноцицептивного воздействия. Однако выраженность угнетения гемодинамических реакций крайне варьировала и зависела от индивидуального типа реагирования животных на боль [Дмитриев А.В., Зайцев А.А., 1981]. Следовательно, транквилизаторы бензодиазепинового ряда, как и опиаты, по-разному влияют на поведенческие и гемодинамические поцицептивные реакции и не могут рассматриваться в качестве лекарственных средств, обеспечивающих надежную стабилизацию гемодинамики при боли. Эти экспериментальные данные созвучны с результатами многочисленных клинических наблюдений, в которых на фоне премедикации транквилизаторами и последующего введения опиатов сохраняются ноцицептивные сдвиги показателей сердечно-сосудистой системы.
В последние годы группа транквилизаторов расширилась за счет соединений — производных ГАМК, обладающих широким спектром фармакологических эффектов (транквилизирующим, ноотропным и др.). К сожалению, те производные ГАМК, которыми располагает современная клиника (мусцимол, баклофен, фенибут и некоторые другие), либо не обладают достаточным вегетокорригирующим эффектом, либо тормозят ноцицептивные гемодинамические реакции в дозах, обусловливающих побочные реакции. Однако исследования, проведенные в нашей лаборатории, выявили отчетливую болеутоляющую и вегетокорригирующую активность некоторых эфиров ГАМК и показали перспективность поиска в ряду се эстерифицированных производных не только гипотензивных, но и антигипертензивных средств и препаратов, нормализующих изменения гемодинамики при боли [Дмитриев А.В., 1984; Дмитриев А.В. и др., 1986].
Выявление анальгетичсского эффекта клофелина, получившего широкое распространение в клинике в качестве антигипертензивного препарата, ознаменовало собой новый этап в развитии вопроса о неопиатной лекарственной аналгезии. Как показано в исследованиях нашей лаборатории, клофелин, наряду с болеутоляющим действием, обладает способностью нормализовать сдвиги гемодинамики при боли различного генеза, и в том числе на модели кардиогенной боли. Эти данные послужили научным обоснованием для испытания клофелина в разрешенных дозах в клинике для терапии различных болевых синдромов.
Клофелин в комплексе анестезиологических мероприятий исследован у онкологических больных, перенесших обширные одно- и двуполостные операции (Московский научно-исследовательский онкологический институт им. П.А. Герцена). Общую анестезию осуществляли по многокомпонентному принципу с использованием фентанила, кетамина, седуксена и закиси азота с добавлением в одной группе больных (21 человек) дроперидола [Осипова Н.А., 1988], в другой (48 человек) — клофелина.
При схеме анестезии без клофелина в момент наиболее травматичного этапа операции систолическое и диастолическое артериальное давление повышалось с (118±3) и (75±1) до (136±3) и (84:4:1) мм рт. ст. соответственно (р<0,05), развивалась достоверная тахикардия. В случае применения клофелина показатели системной гемодинамики не изменялись в течение всей операции (табл. 10). Расход кетамина уменьшался более чем в 2 раза: 1,230 мг/(кг*ч) в контроле, 0,515 мг/(кг*ч) — в группе, получавшей клофелин.
Всем этим 48 больным клофелин назначали подкожно в послеоперационном периоде. У 47 из них выраженный болеутоляющий эффект достигался клофелином (0,13—0,16 мг/сут) в сочетании с баралгином (7,85—15,20 мл/сут). Лишь у 1 больного потребовалась инъекция промедола (20 мкг) с дальнейшим отчетливым болеутоляющим эффектом клофелина и баралгина.
Т а б л и ц а 10
Состояние системной гемодинамики у хирургических, больных на разных этапах операций при проведении многокомпонентной общей анестезии с добавлением клофелина
| Этапы наблюдения | Артериальное давление, мм. рт. ст. | Частота сердечных сокращений уд/мин | |
| систолическое | диастоличе-ское | ||
| Исходное состояние: | |||
| осмотр в палате за сутки до операции | 132±4 | 86±2 | 81±2 |
| Через 10 мин после внутривенного | |||
| введения клофелина: | |||
| на фоне премедикации (седуксен) | 127±3 | 81±2* | 76±2* |
| Сразу после интубации: | |||
| на фоне вводного наркоза (кетамин, фентанил, седуксен) и миорелаксанта (дитилин) | 128±3 | 81±2* | 77±2* |
| Начало хирургического воздействия разрез кожи): | |||
| на фоне основного наркоза (кетамин, фентанил, седуксен, закись азота с кислородом) | 126±3* | 79±2* | 76±2* |
| Наиболее травматичный этап операции: | |||
| торакотомия, ревизия органов брюшной полости и т.п. | 132±3 | 83±2 | 77±2* |
| В конце операции: | |||
| ушивание операционной раны | 129±3 | 82±2* | 77±2* |
| Средние в течение всей операции | 127±2 | 79±1* | 77±1* |
*р <: 0,05 при сравнении с исходным состоянием.
Примечание. Средний расход клофелина составил (0,0014±0,00007) мг/кг массы тела.
Серьезных побочных эффектов в связи с применением клофелина как компонента интра- и послеоперационного обезболивания не отмечено. Отдельные случаи умеренной гипотензии в послеоперационном периоде (систолическое артериальное давление не ниже 80—90 мм рт. ст.) зарегистрированы только у больных с длительным периодом голодания и гиповолемией (рак желудка, пищевода) и быстро купировались стандартной инфузионной терапией.
Клофелин применялся для обезболивания родов у 30 рожениц с нефропатией II степени, при преждевременном излитии околоплодных вод, нормальной родовой деятельности и хорошем состоянии плода (НИИ акушерства и гинекологии, Ленинград). Проводили внутривенную инфузию клофелина в течение 90—120 мин с индивидуальным подбором такой скорости введения, при которой артериальное давление снижалось на 15—20 мм рт. ст. (0,0005—0,01 мг/(кг-ч). Болеутоляющее действие клофелина развивалось через 10—15 мин и сохранялось в течение 180—240 мин после окончания инфузии. Не наблюдалось существенных изменений объемных показателей центральной гемодинамики и нарушений внутриутробного состояния плода. Важно подчеркнуть, что совместное применение клофелина с промедолом в уменьшенной на 50 % дозе (0,1—0,2 мг/кг) способствовало углублению аналгезии по сравнению с той, которую вызывал промедол, и нивелировало его негативное влияние на гемодинамику роженицы и состояние плода.
Эффективность клофелина была подтверждена и при обезболивании при остром инфаркте миокарда у 52 больных (ЛенГИДУВ), у которых болевой синдром не купировался нитратами и нейролептаналгезией. Клофелин вводили внутривенно в дозе 1,5 мкг/кг массы тела струйно в течение 4—5 мин в 20 мл изотонического раствора натрия хлорида, и выявили его отчетливое анальгетическое действие и благоприятное влияние на центральную гемодинамику.
Учитывая данные об отчетливом болеутоляющем действии другого адрснопозитивного соединения — леводопы, его применяли в виде лекарственного препарата «кардопал» (одна таблетка содержит 250 мг леводопы и 25 мг карбидофа) для послеоперационного обезболивания у 9 больных с патологическими процессами в ЛОР-органах (НИИ болезней уха, горла, носа и речи, Ленинград). Кардопал через 30 мин вызывал начальное болеутоляющее действие, достигавшее максимума к концу 1-го часа и сохранявшееся около 4 ч, в течение которых системная гемодинамика оставалась стабильной.
Клинические данные подтвердили отчетливую болеутоляющую активность клофелина, его преимущества и безопасность в терапии различных болевых синдромов по сравнению с традиционными опиатными анальгетиками, перспективность неопиатной медикаментозной коррекции боли и вызванных ею нарушений кровообращения с помощью центральных адренопозитивных средств. Вызываемая ими аналгезия лишена социальных и медицинских (угнетение дыхания, изменение моторики кишечника и др.) недостатков, присущих морфиноподобным препаратам. Следует учитывать, что механизмы анальгетического эффекта морфиноподобных и клофелиноподобных препаратов различны. С этих позиций, перспективным направлением совершенствования лекарственной аналгезии следует считать комбинирование клофелина с анальгетиками наркотического ряда. Важно, что под влиянием лекарственной комбинации гемодинамические ноцицентивные реакции угнетаются сильнее, чем при введении одного клофелина, и что возможно достижение оптимальной аналгезии малыми дозами опиатов, в которых минимизированы их побочные эффекты.
Глава 3
|
|
|


