 |
Восстановление количества белка и белковое питание
|
|
|
|
Поскольку в состоянии натощак азотистый баланс в мышечной ткани отрицателен, восстановление количества мышечного белка определяется преобладанием поглощения аминокислот при приеме белка с пищей. Потребление белковой пищи (например, нежирное мясо) приводит к значительному выходу аминокислот (преимущественно аминокислот с разветвленной цепью) из органов брюшной полости [24]. Валин, изолейцин и лейцин вместе составляют более 60% от общего количества аминокислот, поступающих в системную циркуляцию, несмотря на то что на их долю приходится лишь 20% всех аминокислот, содержащихся в белковых продуктах питания. Одновременно с высвобождением аминокислот из органов брюшной полости обмен большинства аминокислот в периферической мышце изменяется таким образом, что преобладание их выхода, наблюдаемое в исходном состоянии, сменяется на преобладание их поглощения. Как это характерно и для обмена в органах брюшной полости, поглощение аминокислот тканью периферических мышц наиболее выражено применительно к аминокислотам с разветвленной цепью [24]. Поскольку они составляют лишь 20% аминокислотных остатков в мышечном белке, постольку очевидно, что для синтеза белка используются не только эти аминокислоты, но и те, которые образовались в процессе катаболизма в самой мышце.
Описанные эффекты белкового питания на межорганный обмен аминокислотами и ключевая роль аминокислот с разветвленной цепью представлены на рис. 10—9, б. При этом наблюдается азотистый «цикл», когда в состоянии сытости аминокислоты с разветвленной цепью обеспечивают восстановление содержания азота в мышечной ткани. Получаемый таким образом азот как в голодном, так и в сытом состоянии высвобождается в виде аланина и глутамина. Повышение уровня аминокислот с разветвленной цепью в крови и внутри клеток, вызываемое белковым питанием, может иметь значение не только в качестве способа доставки азота.. Аминокислоты с разветвленной цепью, особенно лейцин, могут играть регуляторную роль, стимулируя синтез белка [25]. Кроме того, общее поглощение таких аминокислот мышцей регулируется инсулином и при диабете нарушается [24].
|
|
|
ИНСУЛИН
ИСТОРИЧЕСКИЙ ОЧЕРК
В 1899 г. фон Меринг и Минковский показали, что удаление поджелудочной железы у собак приводит к развитию тяжелых нарушений обмена глюкозы с повышением ее концентрации в крови и клинической картиной сахарного диабета. Предположение о том, что этот эффект является следствием выпадения действия необходимого гормона, было подтверждено в 1921 г., когда
Бантинг и Бест приготовили экстракт поджелудочной железы, способный снижать уровень сахара в крови. Это вещество, названное инсулином,.было получено в кристаллическом виде Абелем в 1926 г. Sanger определил аминокислотный состав инсулина — первого белка, последовательность которого была полностью расшифрована. В 1965 г. Katsoyannis сумел осуществить химический синтез инсулина. В 1969 г. с помощью методик рентгенодифракции была определена трехмерная структура инсулина. Steiner в 1967 г. обнаружил проинсулин — биологический предшественник инсулина более крупного размера. Позднее с помощью методик рекомбинаций ДНК удалось добиться синтеза инсулина бактериями.
ХИМИЯ
Молекула инсулина состоит из двух полипептидных цепей, обозначаемых как А- и В-цепи, соединенные двумя дисульфидными мостиками. Кроме того, имеется дисульфидный мостик между 6-м и 11-м аминокислотным остатком А-цепи (рис. 10—10). Полная молекула содержит 51 аминокислоту и обладает относительной молекулярной массой 5800 и изоэлектрической точкой 5,35; 1мг чистого вещества содержит 24 ME. Аминокислотный состав инсулина у разных видов постоянен, за исключением остатков в положениях 4, 8, 9 и 10 А-цепи и 1, 2, 3, 27, 29 и 30 В-цепи. Чаще всего применяемыми в клинических целях инсулинами являются гормоны, экстрагируемые из поджелудочных желез свиней и крупного рогатого скота. Свиной инсулин отличается от гормона человека только присутствием аланина вместо треонина в терминальном положении В-цепи, тогда как между бычьим и человеческим инсулином существуют еще два различия [в 8-м (аланин) и 10-м (валин) положениях А-цепи] (см. рис. 10—10). Согласно результатам рентгенокристаллографических исследова-
|
|
|

Рис. 10—10, Аминокислотная последовательность инсулина человека. Свиной инсулин в качестве терминальной аминокислоты В-цепи содержит не треонин, а аланин. Бычий инсулин отличается от инсулина человека тем, что содержит аланин в положении 30 В-цепи, а также аланин (вместо треонина) в положении 8 и валин (вместо изолейцина) в положении 10 А-цепи.
яий, единичная ячейка кристаллического свиного инсулина состоит из инсулинового гексамера, построенного из трех димеров, расположенных вокруг оси, на которой лежат два атома цинка. Содержание цинка в большинстве кристаллических препаратов инсулина составляет примерно 0,4—0,5%. В слабых растворах инсулин адсорбируется на стекле или пластмассе (например, на стенках системы для внутривенных инфузий). Эту адсорбцию удается свести к минимуму путем добавления альбумина.
Расщепление инсулина на составляющие его А- и В-цепи путем окисления или восстановления дисульфидных мостиков приводит к полной потере им биологической активности. С другой стороны, удаление амидной группы аспарагина на карбоксильном конце А-цепи или терминального аланина В-цепи практически не влияет на активность молекулы инсулина. При удалении всего аспарагина (или аспартата) из карбоксильного конца А-цепи и аланина из соответствующего участка В-цепи теряется примерно 95% активности гормона. Удаление последовательности из 8 аминокислот (с 23-го по 30-й остаток) с карбоксильного конца В-цепи (инсулин-дезоктапептид) с помощью трипсинового гидролиза приводит к исчезновению всей определимой активности. Считается, что участок между 22-м и 26-м остатком В-цепи имеет решающее значение для связывания инсулина с его рецептором, как и для действия инсулина вообще [27].
|
|
|
БИОСИНТЕЗ
Инсулин синтезируется b-клетками островков Лангерганса в виде одноцепочечного предшественника — проинсулина с молекулярной массой около 9000 [28]. Современные исследования на бесклеточных системахпоказывают, что ближайшим продуктом трансляции проинсулиновой мРНК является более крупный пептид с молекулярной массой 11 500, содержащий 23 дополнительных аминокислотных остатка на аминоконце молекулы. Этот предшественник получил название препроинсулина, и считают, что он быстро (в течение нескольких минут после синтеза) расщепляется микросомными протеазами до проинсулина. Дополнительный пептид в препроинсулине по своему размеру, содержанию отдельных аминокислот и положению на аминоконце сходен с дополнительными последовательностями, найденными в продуктах трансляции in vitro мРНК различных гормонов, таких, как пропаратиреоидный гормон и гормон роста, равно, как и негормональных белков, таких, как легкие цепи иммуноглобулинов [29].
Проинсулин представляет собой спиральную молекулу, в которой А- и В-цепи составляют единую последовательность за счет соединяющего пептида (С-пептида), состоящего из 26—31 аминокислотного остатка (рис. 10—11). Если аминокислотные последовательности А- и В-цепей у разных видов имеют небольшие различия, то строение соответствующих С-пептидов разнится го-

Рис. 10— 11. Схематическое изображение биосинтеза проинсулина, его превращения в инсулин и С-пептид. Ген проинсулина представлен в верхней части рисунка. Эти гены содержат интроны, продукты которых исключаются из состава зрелой мРНК. Транскрипция препроинсулиновой мРНК требует присутствия фермента РНК-полимеразы. Эта мРНК служит матрицей для образования цепей препроинсулина на полирибосомах. Препроинсулин расщепляется до проинсулина (средняя часть рисунка), который затем переносится в аппарат Гольджи (пластинчатый комплекс), где и происходит его превращение в инсулин (по Steiner D. F., Diabetes, 1977, 26, 322). раздо больше. Так, инсулин свиньи отличается от инсулина человека только одной аминокислотой, тогда как С-пептид человека — цепь из 23 аминокислотных остатков с молекулярной массой 3021 — отличается от свиного С-пептида 10 остатками и содержит на 2 аминокислоты меньше [30]. Столь высокая «мутабельность» согласуется с отсутствием у С-пептида специфической гормональной функции. Хотя проинсулин обнаруживает небольшую перекрестную реакцию с антителами к инсулину, он обладает всего" 3—5% от биологической эффективности нативного инсулина, Не ясно, принадлежит ли эта небольшая биологическая, активность непосредственно проинсулину, или она обусловлена его превращением тканями-мишенями в инсулин.
|
|
|
Синтез препроинсулина в клетке и его быстрое? расщепление-до проинсулина происходит на полисомах шероховатого эндоплазматического ретикулума. Затем в ходе энергозависимого процесса проинсулин переносится в пластинчатый комплекс (аппарат Гольджи), где происходит его упаковка в микропузырьки с гладкой поверхностью, в форме которых и осуществляется хранение и секреция (см. рис. 10—11). С момента попадания в пластинчатый комплекс и в секреторных гранулах мембранные протеазы расщепляют проинсулин на эквимолярные количества инсулина и С-пептида. Инсулин вместе с цинком накапливается в центральной области созревающей секреторной гранулы, приобретающей все большую электронную плотность; С-пептид локализуется в периферическом прозрачном пространстве секреторной гранулы.
Высвобождение содержимого зрелых секреторных гранул происходит путем постепенного их продвижения к плазматической мембране клетки, вслед за чем инсулин и С-пептид выталкиваются наружу. Движение гранул к плазматической мембране в цитозоле b-клеток направляется микротрубочками — структурами, имеющими диаметр 24 нм и состоящими из димерных субъединиц белка с молекулярной массой 120 000, известного под названием тубулин. Вблизи плазматической мембраны, окружая секреторные гранулы, располагается сеть микронитей — структур с диаметром 4—8 нм и состоящих, как полагают, из сократительного| белка актина. Принято считать, что на конечном общем этапа секреции b-клеток начинается поступление кальция внутрь клетки, что приводит к сокращению микронитей [31]. В результате секреторные гранулы приближаются к поверхности клеток, где их мембраны сливаются с плазматической мембраной, а их содержимое выбрасывается во внеклеточное пространство. Этот процесс слияния мембран называется эмиоцитозом или экзоцитозом.
|
|
|
Недавняя разработка методов химического синтеза ДНК в сочетании с использованием рекомбинаций ДНК обусловила возможность получения крысиного проинсулина или отдельных А- и В-цепей инсулина человека с помощью бактериальных клеток (Escherichia coli) [26, 32]. План синтеза предполагает либо обратную транскрипцию проинсулиновой мРНК с тем, чтобы полу-

Рис. 10—12. Схематическое изображение синтеза А- и В-цепей инсулина бактерий (Е. coli) с помощью методики рекомбинации ДНК (по Riggs A., Itakura К., Am. J. Hum. Genet, 1979, 31, 351). чить кДНК (ДНК-«копию») для проинсулина, либо химический синтез меньших фрагментов ДНК, кодирующих А- и В-цепи инсулина человека. Синтетические гены затем объединяются с геном, в норме экспрессированном в клетке Е. coli (например, геном пенициллиназы или b-галактозидазы), что обеспечивает эффективную транскрипцию и трансляцию, т. е. образование стабильного белка-предшественника, или (в случае периплазматического белка, такого, как пенициллиназа) способствует транспорту продукта из клетки. Векторами, применяющимися для внесения чужеродной и бактериальной ДНК в бактериальную клетку, служат либо бактериофаги, либо плазмиды. Бактерия, содержащая плазмиду, транскрибирует свой собственный ген, равно, как и внедренную последовательность, продуцируя тем самым нужный полипептид (рис, 10—12). Тот факт, что последователь- ность эукариотической ДНК удается клонировать и экспрессировать в прокариотических (бактериальных) клетках, может найти наиболее быстрое применение в области использования бактериального синтеза для продукции инсулина человека, нужного для лечения больных с инсулинозависимым диабетом. Такая технология тем самым может обеспечить создание альтернативного источника инсулина и в конце концов вытеснить современные способы получения гормона, заключающиеся в экстракции свиных и бычьих поджелудочных желез.
СЕКРЕЦИЯ
Исходные концентрации
Концентрация инсулина в плазме периферической венозной или артериальной крови здоровых лиц после ночного голодания составляет обычно 10—20 мкЕД/мл (0,4—0,8 нг/мл). Как уже отмечалось, в процессе секреции инсулина освобождаются эквимолярные количества С-пептида, концентрация которого натощак составляет 0,9—3,5 нг/мл. Относительно большие количества С-пептида по сравнению с инсулином объясняются более медленным метаболическим клиренсом этого вещества [30]. Поскольку секрет островков поджелудочной железы поступает в воротную веду и поскольку печень элиминирует 50—60% поступающего в нее инсулина, концентрация его натощак в крови воротной вены в 3 раза выше, чем в периферической крови. При резких «всплесках» секреции (например, в ответ на введение глюкозы или аминокислот) градиент уровней инсулина воротная вена — периферическая кровь может повышаться до 10:1. Этот градиент концентраций инсулина может отчасти объяснять тот факт, что небольшой прирост секреции инсулина изменяет метаболизм глюкозы в печени без изменения периферической утилизации глюкозы [33].
Хотя в плазме периферической крови и можно обнаружить проинсулин, обычно на его долю приходится менее 15% от общей иммунореактивности инсулина в циркуляции. Недавно описан бессимптомный генетический дефект — семейная гиперпроинсулинемия с аутосомно-доминантной наследуемостью, при которой на долю проинсулина приходится 65—90% от общей иммунореактивности инсулина в плазме [34]. Отражает этот дефект нарушение превращения проинсулина в инсулин или нарушение биосинтеза проинсулина — неизвестно. Повышение уровня проинсулина в плазме наблюдается и у больных с инсулиномами (см. следующую главу), а также в сочетании с гипокалиемией. У больных диабетом повышение уровня проинсулина встречается довольно редко и не может объяснить нарушения толерантности к глюкозе, наблюдаемое при различных гиперинсулинемических состояниях (например, при ожирении, беременности, гиперкортицизме).
У получающих инсулин больных диабетом присутствие антител препятствует определению инсулина в крови обычными радиоиммунологическими методами. В таких условиях можно оценивать остаточный резерв секреции инсулина с помощью определения С-пептида. Кроме того, у больных с гипогликемией и гиперинсулинемией определение С-пептида может дать ответ на вопрос, имеет ли циркулирующий инсулин эндогенное происхождение (повышение уровня С-пептида) или симптомы связаны с тайным введением инсулина (снижение уровня С-пептида).
Скорость секреции инсулина, необходимая для поддержания нормальной исходной концентрации гормона, колеблется от 0,25 до 1,5 ЕД/ч. Роль исходной секреции (которая в норме происходит в интервалах между приемами пищи) подчеркивается результатами недавно проведенных исследований, свидетельствующими о том, что программированные системы инфузии инсулина,. которые обеспечивают как исходный уровень гормона, так и его повышение перед едой, гораздо более эффективны в отношении; нормализации гликемии при ювенильном диабете, чем только введение повышенных доз инсулина перед едой [35].
Углеводы
Среди различных факторов, способных стимулировать секрецию инсулина, наиболее важным с физиологической точки зрения является глюкоза. Это находит свое отражение в том, что ежемоментные колебания уровня инсулина в плазме повторяют колебания содержания глюкозы в ней (рис. 10—13). Однако точный механизм, с помощью которого глюкоза действует на b-клетки, вызывая высвобождение инсулина, не совсем ясен. Предложены. две альтернативные теории, одна из которых исходит из роли метаболизма глюкозы в островковых клетках, а другая—из взаимодействия молекулы глюкозы с мембранным рецептором — «глюкорецептором». В пользу метаболической теории свидетельствуют следующие наблюдения: 1) метаболизируемые сахара (гексозы или триозы) являются более мощными стимуляторами секреции инсулина, чем неметаболизируемые углеводы (например, манноза); 2) глюкоза увеличивает концентрацию интермедиатов гликолиза в островковых клетках; 3) вещества, угнетающие метаболизм глюкозы (манногептулоза и 2-дезоксиглюкоза), препятствуют секреции инсулина.
С другой стороны, имеются наблюдения, результаты которых свидетельствуют в пользу существования механизма распознавания глюкозы за счет активации ею мембранного рецептора (глюкорецептор), вследствие чего «запускается» процесс высвобождения инсулина. Эту гипотезу подтверждают данные о том, что с помощью блокаторов ферментов (йодацетат) высвобождение инсулина можно отделить от метаболического потока глюкозы по гликолитическому пути и что a-аномер глюкозы служит более эффективным стимулом секреции инсулина, чем b-аномер, хотя
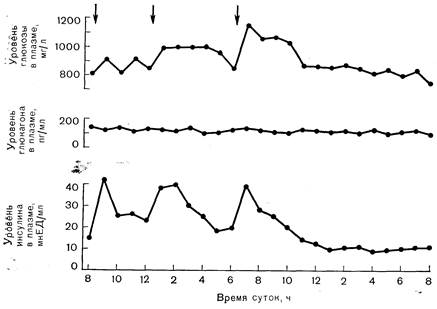
Рис. 10—13. Колебания уровня глюкозы, глюкагона и инсулина в плазме в течение суток у здоровых лиц, потребляющих смешанную пищу. Максимальные размахи уровня глюкозы в плазме за 24 ч обычно не достигают 300 мг/л. Малая степень колебания уровня глюкозы в плазме является следствием обратной связи с секрецией инсулина и повышения секреции инсулина под действием гормонов желудочно-кишечного тракта, выделяющихся в ответ на прием пищи. В отличие от уровня инсулина уровень глюкагона при потреблении смешанной пищи совершенно не меняется (по Tasaka Y. et al., Ногш. Metab. Res., 1975, 7, 205, с модификациями). Стрелками показано время приема пищи. оба аномера подвергаются, по-видимому, одинаковому метаболизму в островковых клетках. Хотя результаты этих наблюдений указывают на стереоспецифичность действия глюкозы, согласно результатам более поздних исследований, a-аномер служит более подходящим субстратом гликолиза в островковых клетках, чем b-аномер, причем стереоспецифичность играет роль на этапе, катализируемом изомеразой фосфоглюкозы [36]. Кроме того, в позднее проведенных исследованиях с йодацетатом были получены данные, которые на самом деле согласуются с метаболической гипотезой [37]. В механизме, с помощью которого гликолиз стимулирует секрецию инсулина, может принимать участие увеличение в клетке уровня НАД-Н и НАДФ-Н, равно как и концентрации R [38].
В процессе стимуляции секреции инсулина, как и во многих других внутриклеточных процессах, принимает участие цАМФ. Считается, что повышение уровня цАМФ выступает прежде всего в качестве положительного модулятора этапа секреции, чувствительного к глюкозе. Тот факт, что теофиллин (ингибитор фосфодиэстеразы) повышает уровень цАМФ, но очень слабо влияет на секрецию инсулина в отсутствие глюкозы, свидетельствует о том, что само по себе увеличение цАМФ является недостаточным условием для стимуляции секреции инсулина.

Рис. 10—14. Внутриклеточная последовательность стимулирующего эффекта глюкозы на секрецию инсулина b-клеткой. Проникновение глюкозы в b-клетку усиливает гликолиз и повышает уровень цАМФ. Эти сдвиги приводят к увеличению внутриклеточного содержания кальция, «запускающего» выброс инсулина.
Как уже отмечалось, конечным этапом триггерного механизма, с помощью которого глюкоза или другие стимулы приводят к высвобождению инсулина из b-клеток, считается увеличение внутриклеточного уровня кальция. Эти изменения кальциевого баланса определяются тормозящим влиянием глюкозы на выход кальция из клетки и мобилизацией внутриклеточных запасов кальция под влиянием цАМФ. На значение изменений внутриклеточного кальция отчетливо указывают результаты исследований с ионофорами—молекулами, действующими в качестве мембранных переносчиков ионов. В присутствии гетероциклической монокарбоновой кислоты А23187 — специфического ионофора двухвалентных катионов, который транспортирует кальций через биологические мембраны, добавление кальция к b-клеткам приводит к «всплеску» секреции инсулина даже без повышения уровня глюкозы или внутриклеточного уровня цАМФ [39].
Общую цепь событий можно суммировать следующим образом проникновение глюкозы в b-клетку усиливает гликолиз, вследствие чего повышается уровень восстановленных пиридиновых нуклеотидов (НАД-Н и НАДФ-Н) и содержание цАМФ. Эти изменения приводят к накоплению кальция, который «запускает» высвобождение инсулина (рис. 10—14).
Характерной особенностью реакции инсулина на глюкозу является ее двухфазность (рис. 10—15). Начальный быстрый «всплеск» секреции начинается в пределах 1 мин после введения глюкозы, достигает максимума в пределах 2 мин и снижается в последующие 3—5 мин. Вторая фаза, характеризующаяся более постепенным приростом уровня инсулина, начинается спустя 5— 10 мин после начала инфузии глюкозы и продолжается в течение

Рис. 10—15. Концентрации иммунореактивного инсулина в плазме крови из воротной и периферической вены до внутривенного введения глюкозы и после него. Натощак концентрация инсулина в плазме воротной вены (1) в 3 раза превышает его уровень на периферии (2), а сразу же после введения глюкозы может превышать периферический уровень в 10 раз (7 наблюдений). Изменения концентрации инсулина в плазме воротной вены указывают на двухфазность реакции b-клеток, в ходе которой резкое увеличение выброса инсулина сменяется более медленным и длительным приростом его (по Blackard W. G., Nelson N. С., Diabetes, 1970, 19, 302).
последующего часа. В опытах на перфузируемой поджелудочной железе ингибитор синтеза белка пуромицин ослабляет выраженность второй фазы, но не влияет на раннюю фазу секреции инсулина. Эти данные позволили предположить, что в b-клетке содержатся два пула инсулина [40]. Остро высвобождаемый пул, содержащий ранее синтезированный инсулин, быстро опустошается в 1-ю фазу секреции. Второй хронический высвобождаемый пул, содержащий вновь синтезируемый инсулин и небольшие количества проинсулина, пополняющие запасы преформированного инсулина, постепенно опустошается во 2-ю фазу. Глюкоза стимулирует синтез инсулина на посттранскрипционном уровне независимо от синтеза новых молекул мРНК [41].
|
|
|


