 |
Где f – коэффициент активности.
|
|
|
|
Коэффициенты активности ионов зависят не только от концентрации сильного электролита, но, кроме того, от концентрации всех посторонних ионов, присутствующих в растворе. Мерой электростатического взаимодействия между ионами считают так называемую ионную силу раствора I, которую вычисляют по формуле:
I = 1/2(С1Z12 + С2Z22 + С3Z32 + СnZn2),
где C1 , C2 , C3 и т.д. – концентрации различных ионов;
Z1, Z2 , Z3 и т. д. заряды этих ионов.
Таким образом, ионная сила раствора равна полусумме произведений концентраций ионов (выраженных в моль/л) на квадраты их зарядов.
Вопросы для самоконтроля
1. Понятие раствора, растворителя, растворенного вещества.
2. Классификация растворов по агрегатному состоянию. Приведите соответствующие примеры.
3. Что такое разбавленные и концентрированные растворы?
4. Способы выражения состава растворов.
5. Растворы электролитов и неэлектролитов. Дайте определение и приведите примеры.
6. Что называют степенью диссоциации электролитов? Приведите примеры сильных и слабых электролитов.
7. Константа диссоциации. Какая зависимость существует между константой и степенью диссоциации электролита? Выразите ее математически.
8. Что такое активность, коэффициент активности и ионная сила раствора?
9. Ионное произведение воды. Водородный показатель рН.
Задания для самоконтроля
1. Дайте определение следующим понятиям:
Растворы –
Электролиты –
Сильные электролиты –
Слабые электролиты –
Неэлектролиты –
Степень диссоциации –
Водородный показатель рН –
Молярная концентрация –
Моляльная концентрация –
2. Допишите определения:
1. Константой равновесия процесса диссоциации слабого электролита называется ____________________________.
|
|
|
2. Гомогенные системы, состоящие из двух и более веществ, называются _____________.
3. Произведение ионов Н+ и ОН – является постоянной величиной для данной температуры и называется _______________________________.
4. Взаимодействие молекул растворителя с частицами (молекулами, ионами) растворенного вещества называется _____________________.
3. Константа равновесия уксусной кислоты выражается отношением:
а) 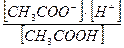 ; в)
; в) 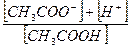 ; д)
; д) 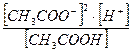 ;
;
б)  ; г)
; г) 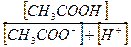 ; е)
; е) 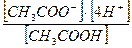
4. Установите соответствие:
| Вещества | Название веществ |
| А) Сильные электролиты Б) Слабые электролиты В) Неэлектролиты | 1) уксусная кислота 2) соляная кислота 3) глюкоза 4) гидроксид натрия 5) серная кислота 6) угольная кислота 7) гидроксид аммония 8) сахароза 9) азотная кислота 10) хлорид кальция 11) сероводород 12) этиловый спирт 13) гидроксид меди 14) неметаллы 15) газы 16) сульфат алюминия |
5. Напишите уравнения электролитической диссоциации по ступеням следующих соединений: Н3РО4, NН4ОН, Н2СО3, Сu(ОН)2.Запишите выражения констант диссоциации для каждой ступени.
6. Вычислите ионную силу: а) 0,03 М раствора ВаСl2;
б) 1 литра раствора, содержащего в 0,1 моль НСl и 0,2 моль СаСl2.
7. Молярная концентрация раствора НСl с массовой долей 2% и плотностью 1,003 г/мл составляет:
а) 0,028 моль/л; г) 0,0055 моль/л;
б) 1,38 моль/л; д) 0,00055 моль/л;
в) 0,55 моль/л; е) 2 моль/л.
8. По мере разбавления раствора, степень диссоциации электролита:
а) увеличивается; б) уменьшается; в) не изменяется
9. Степень диссоциации 0,2 М раствора СН3СООН с Кд = 1,82∙10-5 равна:
а) 0,000091;
б) 0,0136;
в) 0,00954;
г) 0,0419.
10. Заполните пропуски в таблице
«Реакция среды и рН. Кислотность и щелочность растворов»
| [Н+] | 100 | 10-1 | … | … | 10-4 | … | …. | … | … | … | 10-10 | .. | … | … | …. | ||||
| [ОН-] | 10-14 | … | … | … | … | … | 10-8 | … | … | … | … | … | … | … | … | ||||
| среда | Сильнокислая среда | …. | Слабо- щелочная среда | … | |||||||||||||||
| рН | … | … | … | … | … | … | …… | … | … | ||||||||||
11. Выберите правильные ответы:
|
|
|
а) рН = 5, [Н+] = 10-5 М;
б) рОН =3, [Н+] = 10-3 М;
в) С(НСl) = 0,001 моль/л, α=1, рН=3;
г) С (Н2SО4)=0,005 моль/л, рН=2;
д) рН=8, [ОН-] =10-8 М;
е) С(СН3СООН)=0.01 моль/л, α=0,3 [Н+] = 0,01 М;
ж) С(NН4ОН)=0,05, α=0,3 [ОН-]=0,015 М.
IV. 8 Буферные растворы
Буферные растворы – это системы, рН которых практически не меняется при добавлении к ним небольших количеств кислот или щелочей или при разведении.
Буферные системы позволяют живому организму противодействовать влиянию внешних факторов, направленных как на снижение, так и на увеличение рН его жидких сред, сохранять гомеостаз.
|
|
|


