 |
Коллигативные свойства разбавленных растворов
|
|
|
|
Коллигативные свойства растворов – это свойства, которые определяются числом частиц растворенного вещества в единице объема раствора и не зависят от природы вещества. К ним относятся: диффузия, осмотическое давление, давление насыщенного пара растворителя над раствором, температура замерзания раствора, температура кипения раствора.
Диффузия – самопроизвольный процесс переноса вещества в результате беспорядочного теплового движения кинетических единиц. Под кинетическими единицами понимают ионы, молекулы, атомы, ассоциаты, комплексы и т.д. Количественно диффузия выражается законом Фика: Скорость диффузии прямо пропорциональна градиенту концентрации и площади, через которую осуществляется диффузия.
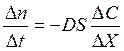 , где
, где
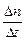 – скорость диффузии, или количество вещества, диффундирующего в единицу времени через данную площадь;
– скорость диффузии, или количество вещества, диффундирующего в единицу времени через данную площадь;
S – площадь поверхности;
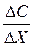 – градиент концентрации – это изменение концентрации (С) вещества, приходящееся на единицу длины (Х) в направлении диффузии. Знак (–) показывает, что диффузия происходит из области большей концентрации в область меньшей.
– градиент концентрации – это изменение концентрации (С) вещества, приходящееся на единицу длины (Х) в направлении диффузии. Знак (–) показывает, что диффузия происходит из области большей концентрации в область меньшей.
D – коэффициент диффузии, зависящий от природы растворенного вещества и от температуры. Физическая сущность D – это количество вещества, диффундирующего в единицу времени через единицу площади при градиенте концентрации, равном 1.
Осмос – это явление односторонней диффузии молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией через полупроницаемую мембрану. Давление, которое надо приложить к раствору, чтобы прекратился осмос, называется осмотическим. Вант-Гофф сформулировал обобщенный закон: осмотическое давление разбавленных растворов равно тому давлению, которое это вещество имело бы, если бы оно в виде газа занимало при той же температуре тот же объем, что и раствор.
|
|
|
Осмотическое давление растворов неэлектролитов можно рассчитать по формуле:
П = CRT, где
П – осмотическое давление;
R –газовая постоянная;
Т – абсолютная температура.
Насыщенный пар – пар, находящийся в равновесии с жидкостью.Давление, которое производит насыщенный пар на стенки сосуда, называется давлением насыщенного пара. Если в равновесную систему ввести нелетучее вещество, то давление пара растворителя над раствором понизится.
Закон Рауля: относительное понижение давления пара растворителя над раствором пропорционально мольной доле нелетучего растворенного вещества.

p0 – давление пара над чистым растворителем;
p – давление пара над раствором;
N – мольная доля растворенного вещества.
Этот закон справедлив только для сильно разбавленных растворов неэлектролитов.
Температура кипения – это температура, при которой давление пара над растворителем или раствором равно атмосферному. Растворы нелетучего растворенного вещества кипят при более высокой температуре, чем чистый растворитель.
Первое следствие из закона Рауля: повышение температуры кипения разбавленного раствора неэлектролита пропорцонально моляльной концентрации растворенного вещества.
∆Ткип. = Е ∙ ḇ(Х), где
∆Т(кип.) – повышение температуры кипения раствора;
ḇ(Х) – моляльность раствора;
Е – эбуллиоскопическая постоянная, показывает повышение температуры кипения раствора при растворении одного моль вещества в 1 кг растворителя.
Температура замерзания – это температура, при которой давление пара растворителя над раствором равно давлению пара растворителя над твердой фазой. Растворы нелетучего растворенного вещества замерзают при более низкой температуре, чем чистый растворитель.
|
|
|
Второе следствие из закона Рауля: понижение температуры замерзания разбавленного раствора неэлектролита прямо пропорционально моляльной концентрации растворенного вещества.
∆ Тзамерз. = К ∙ b(Х), где
∆Тзамерз . – понижение температуры замерзания раствора;
b(Х) – моляльность раствора;
К – криоскопическая постоянная, показывает понижение температуры замерзания, вызываемого растворением одного моль вещества в 1 кг растворителя.
Изотонический коэффициент i. Растворы электролитов не подчиняются законам Рауля и Вант-Гоффа вследствие распада на ионы и увеличении числа кинетически активных частиц. Вант-Гофф ввел поправку для электролитов в виде изотонического коэффициента i.
Коэффициент i показывает, во сколько раз истинная концентрация кинетически активных частиц, и, следовательно, осмотическое давление, понижение давления пара, понижение температуры замерзания, повышение температуры кипения в растворе электролита больше, чем в растворе неэлектролита.
i = 1 + α∙(m - 1), где:
α – степень диссоциации электролита;
m – число ионов, на которое диссоциирует одна молекула электролита.
Для растворов электролитов:
П = і∙C∙ R ∙T; ∆ Ткип. = і ∙ Е ∙ b(Х); ∆ Тзамерз. = і ∙ К ∙ b(Х).
Вопросы для самоконтроля
1. Что такое диффузия? Какие факторы влияют на скорость диффузии?
2. Приведите примеры, характеризующие роль диффузии в процессах жизнедеятельности организма.
3. Какие свойства растворов называются коллигативными и почему?
4. В чем заключается сущность осмоса и осмотического давления?
5. Какие существуют методы измерения осмотического давления?
6. Почему растворы электролитов не подчиняются закону осмотического давления Вант-Гоффа? Охарактеризуйте изотонический коэффициент и его связь со степенью диссоциации электролита.
7.Какие растворы называются изо-, гипо-, гипертоническими? Что происходит с клеткой при помещении её в такие растворы?
8. Какие растворы называются физиологическими? Приведите примеры.
9. Почему при аллергических реакциях, сопровождающихся отеками тканей, в организм вводят высококонцентрированние растворы хлорида кальция (10%) и глюкозы (20%)?
|
|
|
10. В каких системах можно наблюдать явление осмоса? Приведите примеры природных осмотических явлений.
11. Какова биологическая роль осмоса в живых и растительных организмах? Приведите примеры использования явления осмоса в медицинской практике.
12. Дайте определение, что такое насыщенный пар и давление насыщенного пара.
13. Почему нелетучее растворенное вещество понижает давление насыщенного пара? Cформулируйте закон Рауля.
14. Почему растворы электролитов понижают давление насыщенного пара в большей степени, чем растворы неэлектролитов той же концентрации?
15. Дайте определение, что такое температура кипения и замерзания растворов? Сформулируйте следствия из закона Рауля.
16. Как с помощью принципа Ле-Шателье объяснить эффекты повышения температуры кипения и понижения температуры замерзания растворов по сравнению с чистым растворителем?
17. Объясните физический смысл эбулиоскопической и криоскопической констант.
18. Охарактеризуйте взаимосвязь между коллигативными свойствами растворов. Приведите примеры использования криометрии в медико-биологических исследованиях.
Задания для самоконтроля
1. Дополните утверждения:
а) к коллигативным свойствам растворов относятся.....
б) коллигативные свойства растворов определяются.....
в) осмотическое давление растворов зависит от температуры и..
г) значение изотонического коэффициента завит от....
д) физиологический раствор – это раствор, осмотическое давление которого равно.....
2. При одинаковой температуре даны 5 водных растворов с молярной концентрацией 0,05 моль/л. Какие из этих растворов являются изотоничными друг к другу?
а) CaCl2; б) NaCl; в) С6Н12О6; г) MgSO4; д) AlCl3.
3. Какие из следующих водных растворов при температуре 37оС являются гипотоническими по отношению к физиологическому раствору:
а) 0,15 М раствор СаСl2; б) 0,15 М раствор С6Н12О6;
в) 0,1 М раствор МgSO4; г) 0,3 М раствор КСl;
д) 0,3 М раствор С12Н22О11.
4. С помощью стрелок обозначьте соответствие между столбцами таблицы
| Наименование явления | Компоненты |
| 1. Распределение воды между сосудами и внесосудистым пространством в значительной степени определяют компоненты: 2. Основной вклад в осмотическое давление внутриклеточной жидкости вносят компоненты: 3. Основной вклад в поддержание осмоляльности плазмы крови вносят компоненты: | а) катионы калия и сопряженные анионы; б) мочевина; в) белки; г) катионы натрия и сопряженные анионы; д) глюкоза. |
|
|
|
5. Как будет меняться во времени осмотическое давление раствора, в котором происходит ферментативный гидролиз дипептида? Ответ мотивируйте.
6. Как будет меняться во времени осмотическое давление раствора, в котором будет происходить самопроизвольная полимеризация акриловой кислоты? Дайте пояснения.
7. Объясните, почему водный раствор глюкозы кипит при температуре выше 100оС, а водный раствор этанола – при температуре ниже 1000С.
8. С помощью стрелок обозначьте соответствие между столбцами таблицы
| Свойства растворов | Показатели растворов |
| Разбавленные водные растворы NaCI и глюкозы с одинаковой концентрацией имеют: Разбавленные водные растворы глицерина и глюкозы имеют одинаковое осмотическое давление, если у них: | а) различный объем; б) одинаковое давление пара над раствором; в) одинаковый объем; г) различное осмотическое давление при температуре 00С; д) различный цвет; е) различное повышение температуры кипения раствора по сравнению с чистым растворителем; ж) одинаковое понижение температуры замерзания раствора по сравнению с чистым растворителем. |
9. Будут ли изотоничны водные растворы NaCl и MgCl2 с одинаковой массовой долей растворенного вещества? Ответ мотивируйте.
10. Одни кусочки растительной ткани находились в гипертоническом растворе сахарозы, а другие кусочки той же ткани – в гипертоническом растворе мочевины. Просмотр препаратов, сделанных с этих кусочков под микроскопом показал, что в клетках, находившихся в растворе сахарозы, наблюдается устойчивый плазмолиз, который сохраняется долгое время, тогда как в клетках, находившихся в растворе мочевины, отмечается непродолжительный плазмолиз, который сменяется самопроизвольным деплазмолизом. Объясните результаты наблюдений.
11. Вычислите осмотическое давление при 25оС водного раствора, содержащего 171 г сахара С12Н22О11 в 5 литрах раствора.
12. Белок – сывороточный альбумин человека, имеет молярную массу 6900 г/моль. Рассчитайте осмотическое давление раствора, содержащего 2 г белка в 100 г раствора при 25оС; ρр-ра принять равной 1 г/мл.
13. При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С6Н12О6, достигнет 607,8 кПа?
|
|
|
14. Сколько граммов глюкозы С6Н12О6 должно находиться в 0,5 л раствора глюкозы, чтобы его осмотическое давление (при той же температуре) было равно осмотическому давлению раствора глицерина в 1 л которого содержится 9,2 г глицерина(С3Н5(ОН)3)?
15. Осмотическое давление плазмы крови равно 7,7 атм. Рассчитайте,
сколько граммов хлорида натрия необходимо для приготовления 200 мл раствора, изотоничного плазме крови (t= 370С). Степень диссоциации NaCl – 95%.
16. Этиловый спирт иногда вводят внутривенно при гангрене и абсцессе легкого в виде раствора с массовой долей 20%. Определите, будет ли при 37оС данный раствор спирта изотоничен плазме крови? Плотность раствора равна 1 г/мл.
17. Рассчитайте кажущуюся степень диссоциации LiCl в растворе с молярной концентрацией эквивалента 0,1 моль/л, если раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 0оС.
18. Осмотическое давление раствора, содержащего в 1 л 72 г маннита, равно 9,00 ∙ 105 Па при 0оС. Найдите формулу маннита, если массовая доля С, Н и О, входящих в его состав, соответственно равны 39,56; 7,69; 52,75 %.
19. К 100 мл 0,5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25оС?
20. Сколько моль неэлектролита должно содержаться в 1л раствора, чтобы его осмотическое давление при 25оС было равно 2,47 кПа?
21. Определить степень диссоциации бромида алюминия, если 1 литр раствора, содержащего 26,7 г растворенного вещества, создает при 0оС осмотическое давление, равное 635,22 кПа.
22. Определить степень диссоциации СаCl2 в 0,2 М растворе, если при той же температуре этот раствор изотоничен 0,5М раствору глюкозы.
23. Дополните следующие утверждения:
а) законам Рауля и Вант-Гоффа не подчиняются растворы.....
б) относительное понижение давления пара растворителя над раствором равно.....
в) температурой кипения называется температура, при которой...
г) температурой замерзания называется температура, при которой.
д) растворенное вещество......... температуру кипения и.....
температуру замерзания раствора по сравнению с чистым растворителем;
ж) онкотическое давление крови обусловлено.....
з) изоосмия организма – это.....
и) плазмолиз эритроцитов происходит, когда клетку помещают..
24. Укажите правильные утверждения:
а) давление насыщенного пара над раствором уменьшается при увеличении мольной доли растворителя;
б) температура кипения жидкостей и их растворов зависит от внешнего давления;
в) при увеличении числа частиц растворенного нелетучего вещества в единице массы растворителя температура замерзания растворов повышается;
г) при одинаковых условиях водные растворы нелетучих электролитов и неэлектролитов, имеющих равные моляльности, имеют разные температуры кипения;
д) при одинаковой температуре водные растворы нелетучих электролитов и неэлектролитов с одинаковой молярной концентрацией имеют одинаковое осмотическое давление.
25. Над океаном или морем давление паров воды ниже, чем над озером или рекой с пресной водой. Почему влажность воздуха на берегу океана или моря выше по сравнению с влажностью воздуха около озера или реки?
26. С помощью стрелок обозначьте соответствие между столбцами таблицы
| Свойства растворов | Показатели растворов |
| 1. Разбавленные водные растворы КСl и Na3РО4 кипят при одинаковой температуре, если у них: 2. Разбавленные водные растворы глюкозы и К2SO4 имеют одинаковое осмотическое давление, если у них: | а) одинаковая концентрация и степень диссоциации электролита; б) концентрации KCl и Na3PO4 равны соответственно 0,4 и 0,1моль/л; α = 1; в) концентрации KCl и Na3PO4 равны соответственно 0,06 и 0,24 моль/л; α = 1; г) концентрация глюкозы в 4 раза меньше концентрации K2SO4; д) одинаковое понижение температуры замерзания; ж) одинаковая массовая доля растворенного вещества; з) концентрация глюкозы в 4 раза выше концентрации K2SO4. |
27. 68,4 г сахарозы растворено в 1000 г воды. Рассчитать:
а) осмотическое давление; (Т= 298 К, ρр-ра = 1,01 г/мл)
б) температуру замерзания;
в) температуру кипения раствора.
28. Температура кипения водного раствора сахарозы равна 101,40С. Вычислите моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор?
29. Водно-спиртовый раствор, содержащий 15% спирта (ρ = 0,97 г/мл) замерзает при температуре 10,260С. Найдите молекулярную массу спирта и осмотическое давление раствора при 250С.
30. Температура замерзания кровяной сыворотки равна (- 0,560С). Рассчитайте моляльность солей в крови, условно считая все соли бинарными и полностью распадающимися на ионы по схеме: КtAn→ Кt+ + Аn−. Наличие в сыворотке крови неэлектролитов во внимание не принимать.
31. Эксперименты по исследованию 0,01М водных растворов сахарозы, глюкозы, глицерина показали, что понижение температуры замерзания у них равны 0,0186 0С. Почему понижение температуры замерзания водного раствора NaCl оказалось в 2 раза больше, раствора СаCl2 в три раза больше, а раствора AlCl3 в четыре раза больше.
32. В равных количествах воды растворено: в одном случае 0,5 моль сахарозы, в другом – 0,2 моль CaCl2. Температуры замерзания обоих растворов одинаковы. Определите кажущуюся степень диссоциации CaCl2.
33. Раствор, содержащий 1,2 г аспирина (С6Н4СН3СООСООН) в 20 г диоксана, замерзает при температуре 10,430С. Определите криоскопическую постоянную диоксана.
34. Температура замерзания раствора, содержащего 0,25 моль азотной кислоты в 2,5 л воды равна -0,350С. Рассчитайте изотонический коэффициент азотной кислоты.
35. Некоторое количество вещества, растворенное в 100 г бензола, понижает температуру его замерзания на 1,28 0С. То же количество вещества, растворенное в 100 г воды, понижает точку ее замерзания на 1,395 0С. Вещество находится в бензоле в виде молекул, а в воде полностью диссоциировано на ионы. На сколько ионов вещество диссоциирует в водном растворе?
36. В 100 мл воды растворено 4 г неэлектролита, в состав которого входят С (50,7%), Н (4,23%), О (45,07%). Раствор замерзает при температуре − 0,524 0С. Определите формулу растворенного вещества.
37. Раствор, содержащий 0,04 г камфоры в 20 г бензола замерзает при температуре на 0,067 0C ниже температуры замерзания чистого бензола. Определите молярную массу камфоры.
38. Какова температура замерзания раствора неэлектролита, содержащего 3,01 ∙ 1023 молекул в 1 л воды?
39. Водный раствор мочевины кипит при температуре 100,5 0С. Рассчитайте осмотическое давление раствора при температуре 250С; ρр-ра = 1,1 г/мл.
40. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при температуре 45,529 0С. Температура кипения сероуглерода равна 46,30С. Вычислите эбулиоскопическую постоянную СS2.
Литература
1. Глинка Н.А. Общая химия / Н.Л. Глинка. – М.: Интеграл-пресс, 200.
2. Ершов Ю.А. Общая химия /Ю.А. Ершов, А.С. Попков, А.С. Берлянд, А.З. Книжник, Н.И. Михайличенко. – М.: Высш.шк., 2003.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию /А.С. Ленский. – М.: Высш.шк., 1989.
4. Пузаков С.А. Химия / С.А. Пузаков. – М.: Химия, 2006.
5. Равич-Щербо М.И. Физическая и коллоидная химия /М.И. Равич-Щербо, В.В. Новиков. – М.: Высш.шк., 1975.
6. Селезнев К.А. Аналитическая химия / К.А. Селезнев. – М., 1973.
Ответы
Раздел I
I.3
13. б.
РАЗДЕЛ II
II.4
10. 79; 11. 247; 12. 20; 13. 223; 14. 1525; 15. 120; 13,3; 16. 46; 17. 42504; 18. -45; 19. а) 96; б) 489; в) 27.
II.5
12. а) 222; б) -207; в) 3,3; 13. 7; 14. -19; 15. а) 119; б) -3,3; 16. -962; 17. 957; 18. 428; 19. 70.
РАЗДЕЛ III
III.6
1. б; 2. а; 3. в; 4. г; 5. в; 6. 2; 7. 3; 8. 1,33; 0,33;0,67; 0,67; 9. 2,3·10-4; 13. а.
РАЗДЕЛ IV
IV.7
6. а) 0,09, б) 0,7; 7. в; 9. в; 11. а, в, г, ж.
IV.8.
3. 6,45; 4. 6,35; 5. 4,94; 6. 9,25; 9,43; 9,07; 9,25; 7. 1:1; 8. 40; 9. 6,99.
IV.9
2. б, г; 3. б, в; 11. 2,44; 12. 0,071; 13. 292,7; 14. 9; 15. 1,82; 16. гипертоничен, 110,5; 17. 90%; 18. С6Н14О6; 19. 3,05; 20. 0,001; 21. 60%; 22. 75%; 27. а) 4,62; б) -0,372; в) 100; 28. 2,69; 9,2%; -5; 29. 32; 0,11; 30. 0,15; 32. 75%; 33. 4,71; 34. 1,88; 35. 3; 36. С6Н6О4; 37. 151,3; 38. − 0,93; 39. 24,4; 40. 2,29.
СОДЕРЖАНИЕ
Введение…………………………………………………………...………..3
РАЗДЕЛ I. Строение атома и химическая связь………………………….4
I.1 Строение атома……………………………………...………..4
I.2 Химическая связь…………………………………..………..11
I.3 Комплексные соединения………………………….……….22
РАЗДЕЛ II. Термодинамика…………………………………..………….30
II.4 Первое начало (Первый закон) термодинамики. Термохимия…………………………..………………….30
II.5 Второе начало (Второй закон) термодинамики. Термодинамические потенциалы… …..………………..37
РАЗДЕЛ III. Кинетика, катализ, химическое равновесие………….…..43
III.6 Кинетика, катализ, химическое равновесие……….……43
РАЗДЕЛ IV. Растворы…………………………………………….………48
IV.7 Растворы. Свойства растворов электролитов……………48
IV.8 Буферные растворы………………………………………..56
IV.9 Учение о растворах. Диффузия в растворах. Коллигативные свойства растворов………………..…….60
ЛИТЕРАТУРА………………………….…………………………………71
ОТВЕТЫ………………………………….……………………………….72
ПРИЛОЖЕНИЯ …………………………..………………………………74
Приложение 1
Периодическая таблица химических элементов Д.И. Менделеева
Приложение 2
Относительная электроотрицательность атомов элементов по Полингу
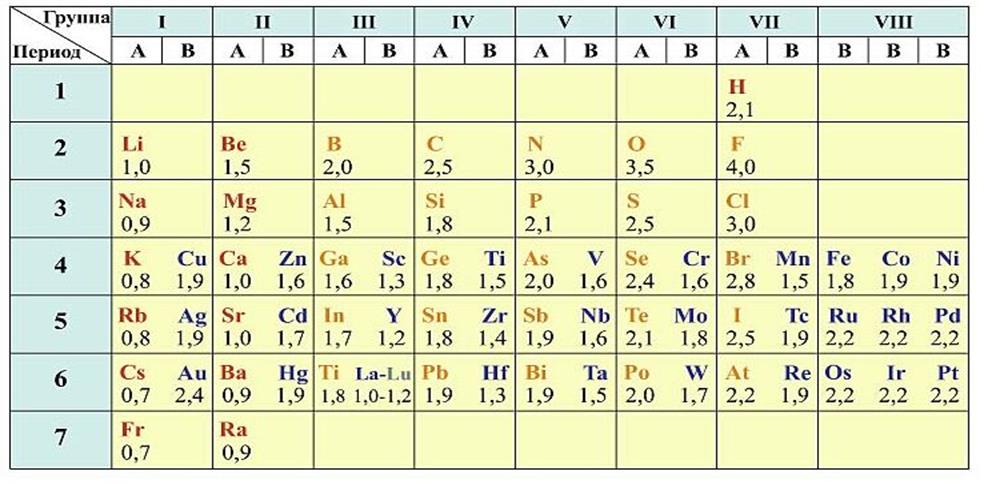
Приложение 3
Термодинамические константы некоторых веществ
| Вещество | ∆Н°298, кДж/моль | ∆G°298, кДж/моль | S°298, Дж/моль∙К |
| С (графит) | |||
| СН4 (г) | -75 | -51 | |
| СН3ОН (г) | -201 | -66 | |
| С2Н2 (г) | |||
| С2Н5ОН (г) | -235 | -174 | |
| С6Н12О6 (тв) | -1274 | -911 | |
| СО (г) | -111 | -137 | |
| СО2 (г) | -394 | - 394 | |
| СS2 (г) | |||
| СаСО3 (тв) | -1207 | -1129 | |
| СаО (кр) | -636 | -604 | |
| СаSО4 (тв) | -1433 | -1320 | |
| FeO (тв) | -265 | -244 | |
| Fe2O3 (тв) | -822 | -740 | |
| Fe3O4 (кр) | -1117 | -1014 | |
| Н2 (г) | |||
| Н2О (г) | -242 | -229 | |
| Н2О (ж) | -286 | -238 | |
| Н2S (г) | -21 | -34 | |
| Н2SО4 (ж) | -814 | -690 | |
| K+ (р-р) | -251 | -282 | |
| KNO3 (тв) | -493 | -393 | |
| K2SO4 (тв) | -1434 | -1316 | |
| N2 (г) | |||
| NH3 (г) | -46 | -17 | |
| NO (г) | |||
| NO2 (г) | |||
| N2O4 (г) | |||
| NO3– (р-р) | -207 | -114 | |
| Na2SO4 (тв) | -1385 | -1267 | |
| Na2S2O3 ×5H2O (тв) | -2602 | - | - |
| O2 (г) | |||
| S(кр.,ромб.) | |||
| SO2 (г) | -297 | -300 |
Приложение 4
|
|
|


